SCERT AP 10th Class Physical Science Guide 8th Lesson మూలకాల రసాయన బంధం Textbook Questions and Answers.
AP State Syllabus 10th Class Physical Science 8th Lesson Questions and Answers రసాయన బంధం
10th Class Physical Science 8th Lesson రసాయన బంధం Textbook Questions and Answers
అభ్యసనాన్ని మెరుగుపరుచుకోండి
ప్రశ్న 1.
రెండు పరమాణువుల మధ్య ఎలాంటి బంధం ఏర్పడుతుంది అనే దానిని నిర్ణయించే అంశాలను పేర్కొనండి. (AS1)
(లేదా)
రెండు పరమాణువుల మధ్య ఏర్పడు బంధంను నీవెలా గుర్తిస్తావో వివరించుము.
జవాబు:
రెండు పరమాణువుల మధ్య ఎలాంటి బంధం ఏర్పడుతుంది అనే దానిని నిర్ణయించే అంశాలు :
- పరమాణువుల మధ్య ఆకర్షణ లేక వికర్షణ బలాలు.
- వేలన్సీ కక్ష్యలో గల ఎలక్ట్రానులు (వేలన్సీ ఎలక్ట్రాన్స్).
ప్రశ్న 2.
సంయోజక ఎలక్ట్రాన్లకు, సంయోజకతకు గల తేడా ఏమిటి? (AS1)
(లేదా)
వేలన్సీ ఎలక్ట్రానులకు, సంయో ,ఒకతకు మధ్యగల భేదంను వివరించుము.
జవాబు:
సంయోజక ఎలక్ట్రాన్లు :
- ఒక పరమాణువు యొక్క చిట్టచివరి కర్పరంలో గల ఎలక్ట్రానుల సంఖ్యను సంయోజక ఎలక్ట్రాన్లు అంటారు.
- సోడియం పరమాణువు యొక్క పరమాణు సంఖ్య (Z = 11). దాని ఎలక్ట్రాన్ విన్యాసం 2, 8, 1.
- మొదటి కర్పరంలోని ఎలక్ట్రానుల సంఖ్య 2, రెండవ కర్పరంలోని ఎలక్ట్రానుల సంఖ్య 8, మూడవ కర్పరం అనగా చివరి కర్పరంలోని ఎలక్ట్రానుల సంఖ్య 1. కనుక సోడియం పరమాణువులోని సంయోజక ఎలక్ట్రాన్లు 1.
సంయోజకత :
- ఒక మూలక పరమాణువు ఎన్ని ఇతర పరమాణువులతో బంధంలో పాల్గొనగలదో తెలిపే సంఖ్యను ఆ మూలకం యొక్క సంయోజకత అంటారు.
- క్లోరిన్ పరమాణు సంఖ్య (Cl = 17).
దాని ఎలక్ట్రాన్ విన్యాసము 1s²2s² 2px² 2py² 2pz² 2px² 2py² 2p2¹. - దీనిలో వేలన్సీ ఎలక్ట్రాన్ల సంఖ్య 7. కానీ ఇది అష్టక విన్యాసం కొరకు ఒక పరమాణువుతో బంధం ఏర్పరచుకోగలదు.
- కావున క్లోరిన్ పరమాణువు సంయోజనీయత 1.
![]()
ప్రశ్న 3.
ఈ క్రింది లూయిస్ గుర్తు ఏ సమ్మేళనానికి ఉంటుంది? (AS1)
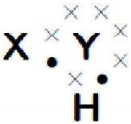
జవాబు:
ఈ లూయిస్ గుర్తు నీలి సమ్మేళనానికి ఉంటుంది.
a) Y మూలకముపై ఎన్ని వేలన్సీ ఎలక్ట్రానులున్నాయి?
b) ‘Y’ యొక్క వేలన్సీ ఎంత?
జవాబు:
2
c) ‘X’ యొక్క వేలన్సీ ఎంత?
జవాబు:
1
d) ఆ అణువులో ఎన్ని సంయోజనీయ బంధాలున్నాయి?
జవాబు:
2
e) X మరియు Y లకు సరియైన పేర్లు సూచించండి.
జవాబు:
X – అనేది హైడ్రోజన్ మరియు Y – అనేది ఆక్సిజన్. ఏర్పడిన అణువు H2O.
ప్రశ్న 4.
బాహ్యకక్ష్యలో ఉన్న ఎలక్ట్రానులు మాత్రమే బంధంలో పాల్గొంటాయి? లోపలి కక్ష్యలో ఎలక్ట్రాన్లు పాల్గొనవు. ఎందుకు? (AS1)
జవాబు:
- పరమాణువుల మధ్య బంధం ఏర్పడి అణువులుగా మారునప్పుడు, పరమాణువులలోని చివరి కర్పరంలో గల ఎలక్ట్రానులు మాత్రమే ప్రభావితం అవుతాయి.
- పరమాణువులలోని లోపలి కర్పరంలో గల ఎలక్ట్రానులు గానీ, వాటి కేంద్రకాలుగానీ ప్రభావితం కావు.
- పరమాణువులలోని లోపలి కర్పరంలో గల ఎలక్ట్రానులు కేంద్రకంచే బలంగా ఆకర్షింపబడి ఉండుట వలన అవి రసాయన బంధంలో పాల్గొనవు.
- కనుక, బాహ్యకక్ష్యలోని ఎలక్ట్రానులు మాత్రమే బంధంలో పాల్గొంటాయి. లోపలి కక్ష్యలోని ఎలక్ట్రాన్లు పాల్గొనవు.
ప్రశ్న 5.
ఎలక్ట్రాన్ మార్పిడి సిద్ధాంతం ప్రకారం సోడియంక్లోరైడ్ మరియు కాల్షియంఆక్సెడ్ ఏర్పాటును వివరించండి. (AS1)
(లేదా)
కోసల్స్ సిద్ధాంతం ప్రకారం ఏవైనా రెండు సమ్మేళనాలు ఏర్పడుటను వివరింపుము.
జవాబు:
సోడియంక్లోరైడ్ ఏర్పడుట (Nacl) :
- సోడియం మరియు క్లోరిన్ మూలక పరమాణువులు సంయోగం చెందడం వలన సోడియం క్లోరైడ్ అణువు ఏర్పడుతుంది.
- సోడియం పరమాణువు తన బాహ్య కక్ష్యలో అష్టకంను పొందుటకు ఒక ఎలక్ట్రాన్ను కోల్పోయి Na+ అయాన్గా ఏర్పడడం ద్వారా నియాన్ (Ne) ఎలక్ట్రాన్ విన్యాసాన్ని పొందుతుంది.
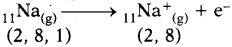
- క్లోరిన్ పరమాణువు దాని చివరి కక్ష్యలో అష్టకంను పొందటానికి దానికి 1 ఎలక్ట్రాను అవసరం. కావున సోడియం కోల్పోయిన ఆ ఎలక్ట్రాను గ్రహించి Cl– అయాగా ఏర్పడటం ద్వారా ఆర్గాన్ (Ar) ఎలక్ట్రాన్ విన్యాసంను పొందుతుంది.
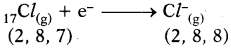
- సోడియం (Na) మరియు క్లోరిన్ (CU) పరమాణువుల మధ్య ఎలక్ట్రాన్ మార్పిడి వలన ఏర్పడిన Na+ మరియు Cl– అయాన్ల మధ్య స్థిర విద్యుదాకర్షణ బలాల వల్ల అవి రెండూ పరస్పరం ఆకర్షణకు గురై సోడియం క్లోరైడ్ NaCl అనే క్రొత్త సంయోగ పదార్థం ఏర్పడుతుంది.
2. Na++ Cl– → Na+Cl–(లేదా) Nacl
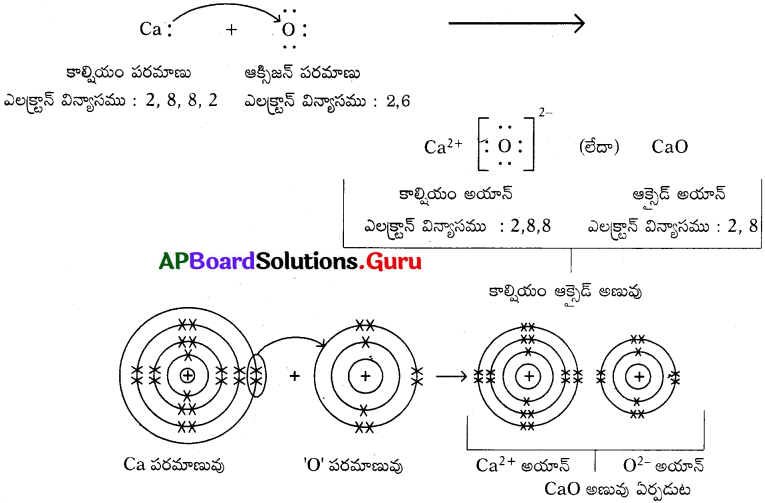
కాల్షియం ఆక్సైడ్ ఏర్పడుట (CaO) :
- కాల్షియం మరియు ఆక్సిజన్ మూలక పరమాణువులు సంయోగం చెందడం వలన కాల్షియం ఆక్సెడ్ అణువు ఏర్పడుతుంది.
- కాల్షియం పరమాణువు (Z = 20), ఎలక్ట్రాన్ విన్యాసము (2, 8, 8, 2).
- తన బాహ్యకక్ష్యలో అష్టకంను పొందుటకు రెండు ఎలక్ట్రానులను కోల్పోయి Ca2+ అయానుగా మారుతుంది.
- ఆక్సిజన్ పరమాణువు (Z = 8). ఎలక్ట్రాన్ విన్యాసము (2, 6).
- తన బాహ్యకక్ష్యలో అష్టకంను పొందుటకు రెండు ఎలక్ట్రానులను గ్రహించి O2- అయానుగా మారుతుంది.
- కాల్షియం (Ca) మరియు ఆక్సిజన్ (O) పరమాణువుల మధ్య ఎలక్ట్రాన్ల మార్పిడి వలన ఏర్పడిన Ca2+ మరియు O2- అయాన్ల మధ్య స్థిర విద్యుదాకర్షణ బలాల వల్ల అవి రెండూ పరస్పరం ఆకర్షణకు గురై కాల్షియం ఆక్సైడ్ (Ca0) అనే కొత్త సంయోగ పదార్థం ఏర్పడుతుంది.
![]()
ప్రశ్న 6.
A, B మరియు C అనేవి వరుసగా పరమాణు సంఖ్య 6, 11 మరియు 17 గల మూలకాలు. అయిన (AS1)
i) ఏవి అయానిక బంధాన్ని ఏర్పరచవు? ఎందుకు?
జవాబు:
‘A’ అయానిక బంధమును ఏర్పరచదు. దాని వేలన్సీ ఎలక్ట్రానుల సంఖ్య 4. 4 ఎలక్ట్రానులను కోల్పోవడం గాని లేదా. గ్రహించడం గాని కష్టము. అందువలన A మూలకము అయానిక బంధాన్ని ఏర్పరచదు.
ii) ఏవి సంయోజనీయ బంధం ఏర్పరచవు? ఎందుకు?
జవాబు:
‘B’ సంయోజనీయ బంధాన్ని ఏర్పరచదు. దాని వేలన్సీ ఎలక్ట్రానుల సంఖ్య 1. అందువలన ‘B’ మూలకము ” ఎలక్ట్రానులను దానం చేసి అయానుగా మారడం సులభం. కనుక అది అయానిక బంధమును ఏర్పరచును.
iii) ఏవి అయానిక మరియు సంయోజనీయ బంధాలను ఏర్పరచగలవు?
జవాబు:
‘C’ మూలకము అయానిక మరియు సంయోజనీయ బంధాలను ఏర్పరచగలదు.
ప్రశ్న 7.
అణువుల యొక్క బంధశక్తులు, బంధకోణాలు, వాని రసాయన ధర్మాలను అంచనా వేయడంలో ఏ విధంగా ఉపయోగపడతాయి? (AS1)
(లేదా)
అణువుల యొక్క రసాయన ధర్మాలను ఏవిధముగా బంధశక్తులు, బంధకోణాలు ప్రభావితం చేస్తాయో వివరింపుము.
జవాబు:
- ఒక మోల్ H – H బంధాలను విచ్చేదన చేయడానికి 436 KJ బంధశక్తి అవసరమౌతుంది.
- ఒక మోల్ Cl – Cl బంధాలను విచ్ఛేదన చేయడానికి 243 KJ బంధశక్తి అవసరమౌతుంది.
- పై విలువలను బట్టి H2 యొక్క ద్రవీభవన, బాష్పీభవన ఉష్ణోగ్రతలు Cl2 కన్నా ఎక్కువగా ఉండవచ్చని అంచనా వేయవచ్చు.
- అలాగే H – H బంధదూరం 0.74A° మరియు Cl – Cl బంధదూరం 1.95 A°.
- కనుక బంధదూరం తగ్గిన కొద్దీ బంధశక్తి ఎక్కువగా ఉంటుందని, బంధదూరం పెరిగిన కొద్దీ బంధశక్తి తక్కువగా ఉండవచ్చని అంచనా వేయవచ్చు.
ప్రశ్న 8.
అయానిక సమ్మేళనాలతో పోల్చినపుడు, సమయోజనీయ సమ్మేళనాలు, అల్ప ద్రవీభవన స్థానాలను కల్గి ఉండటానికి కారణాలను ఊహించండి. (AS2)
(లేదా)
సమయోజనీయ సమ్మేళనాలు అల్ప ద్రవీభవన స్థానాలను కలిగి ఉండుటకు గల కారణాలను వ్రాయుము.
జవాబు:
- అయానిక సమ్మేళనాలు స్పటిక ఘనపదార్థాలు. అందువలన ఇవి అధిక ద్రవీభవన స్థానాలను కలిగి ఉంటాయి.
- అయానిక సమ్మేళనాలతో పోల్చినపుడు, సమయోజనీయ సమ్మేళనాలు అల్ప ద్రవీభవన స్థానాలను కలిగి ఉంటాయి.
- దీనికి కారణము :
1) సంయోజనీయ పదార్థాలలోని అణువులు బలహీనమైన వాండర్ వాల్ బలాలు లేక ద్విధృవ – ద్విధృవ ఆకర్షణ బలాలతో నిర్మితాలై ఉండడమే.
2) ఈ విధమైన అణువులను వేరుజేయడానికి చాలా తక్కువ శక్తి అవసరము.
3) అల్ప ద్రవీభవన ఉష్ణోగ్రతల వద్ద పరమాణువుల మధ్యనున్న, బంధాలు విడదీయబడతాయి.
4) అందువలన అల్ప ద్రవీభవన స్థానాలను కలిగి ఉంటాయి.
ప్రశ్న 9.
సమయోజనీయ సమ్మేళనాల ధర్మాలకు, ఉపయోగాలకు సంబంధించిన సమాచారంను సేకరించండి. ఒక నివేదికను తయారు చేయండి. (AS4)
(లేదా)
సమయోజనీయ సమ్మేళనాల ధర్మాలను, ఉపయోగాలను చూపు నివేదికను తయారుచేయుము.
(లేదా)
సమయోజనీయ సమ్మేళనాల రెండు ధర్మాలు మరియు రెండు ఉపయోగాలను తెలపండి.
జవాబు:
నివేదిక
సమయోజనీయ సమ్మేళనాల ధర్మాలు :
- అయానిక ఘన పదార్థాల్లోలాగా కాకుండా సమయోజనీయ సంయోగపదార్థాలు వివిక్త అణువులుగా ఉంటాయి. ఆ అణువుల మధ్య వాండర్ వాల్స్ బలాల ద్వారా ఆకర్షణ ఉంటుంది. అందుకే సమయోజనీయ పదార్థాలు ఘన, ద్రవ, వాయు స్థితి, మూడు స్థితుల్లో ఉంటాయి. ఉదా : I2 (ఘన), Br2 (ద్రవ), Cl2 (వాయు).
- సమయోజనీయ సంయోగ పదార్థాలకు సాధారణంగా తక్కువ బాష్పీభవన, ద్రవీభవన స్థానాలుంటాయి. అయితే డైమండ్ లాంటి త్రిమితీయ నెట్ వర్క్ నిర్మాణాలున్న పదార్థాలకు అధిక ద్రవీభవన, బాష్పీభవన స్థానాలుంటాయి.
- సాధారణంగా సమయోజనీయ సంయోగ పదార్థాలు చాలా బలహీనమైన విద్యుద్వాహకాలు లేదా అవిద్యుద్వాహకాలు. గ్రాఫైట్ లాంటి విద్యుద్వాహకాలు అరుదుగా ఉంటాయి.
- సమయోజనీయ సంయోగ పదార్థాలు ధ్రువ ద్రావణాల్లో సాధారణంగా కరుగవు. అయితే బెంజీన్, కార్బన్ టెట్రాక్లోరైడ్ వంటి అధ్రువ ద్రావణాల్లో కరుగుతాయి.
- సమయోజనీయ బంధాలు దిశాత్మకం కాబట్టి సమయోజనీయ సంయోగ పదార్థాలకు స్థిరమైన ఆకృతులుంటాయి.
సమయోజనీయ సమ్మేళనాల ఉపయోగాలు :
- మన శరీరంలో 99% సమయోజనీయ సమ్మేళనాలు ఉన్నాయి.
- నీరు సమయోజనీయ సమ్మేళనము. నీటి యొక్క వివిధ ఉపయోగాలు మనకు తెలిసినవే.
- మనకు వివిధ రకాలుగా ఉపయోగపడే పంచదార, వివిధ రకాల ఆహార పదార్థాలు అన్నీ సమయోజనీయ సమ్మేళన పదార్థాలే.
ప్రశ్న 10.
ఈ క్రింది అణువులలో ఎలక్ట్రాన్ల అమరికను చూపే పటాలను గీయండి. (AS5)
a) కాల్షియం ఆక్సెడ్ (CaO) b) నీరు (H2O) c) క్లోరిన్ (Cl2)
లేదా
ఎలక్ట్రాను చుక్క పద్ధతి ద్వారా CaO, H2O, Cl2 అణువులు ఏర్పడుటను చూపుము.
జవాబు:
a) కాల్షియం ఆక్సైడ్ (CaO) :
b) నీటి అణువు (H2O) :
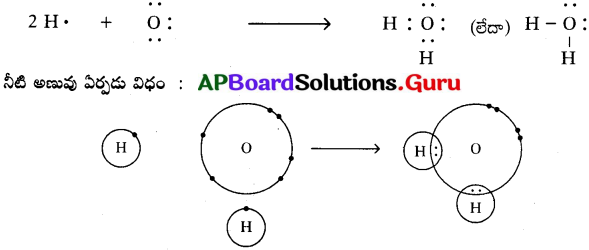
ఒక ఆక్సిజన్ పరమాణువు, రెండు హైడ్రోజన్ పరమాణువులతో కలిసి నీటి అణువు ఏర్పడుతుంది.
c) క్లోరిన్ అణువు (Cl2) :
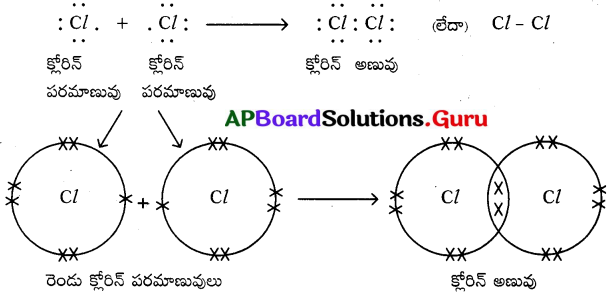
ప్రశ్న 11.
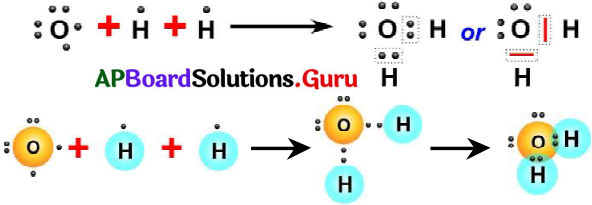
లూయిస్ గుర్తును ఉపయోగించి H2O అణువును ఎలా సూచిస్తారు? (AS5)
జవాబు:
- నీటి అణువులో రెండు O – H ఏక సంయోజనీయ బంధాలు ఉంటాయి.
- ఆక్సిన్ (8O) ఎలక్ట్రాన్ విన్యాసం 2, 6.
- హైడ్రోజన్ (1H) ఎలక్ట్రాన్ విన్యాసం 1.
- ఆక్సిజన్ పరమాణువు అష్టక విన్యాసం పొందాలంటే, దానికి మరో రెండు ఎలక్ట్రానులు అవసరం.
- కాబట్టి ఆక్సిజన్ పరమాణువు దాని చివరి కక్ష్యలో ఉన్న ఎలక్ట్రాన్లను రెండు హైడ్రోజన్ పరమాణువులలో గల ఒక్కొక్క ఎలక్ట్రాతో పంచుకోవడం వలన H2O అణువు ఏర్పడుతుంది.
ప్రశ్న 12.
క్రింది ఇవ్వబడిన అణువులను లూయిస్ గుర్తు ద్వారా సూచించండి. (AS5)
a) బెరీలియం b) కాల్షియం c) లిథియం
జవాబు:
a) బెరీలియం :
బెరీలియం పరమాణువు సంఖ్య (Z = 4). దీని ఎలక్ట్రాన్ విన్యాసము 2, 2. బాహ్యకర్పరంలోని ఎలక్ట్రానుల సంఖ్య 2. లూయిస్ గుర్తు ద్వారా దీనిని క్రింది విధంగా సూచించవచ్చు.
![]()
b) కాల్షియం :
కాల్షియం పరమాణు సంఖ్య (Z = 20). దాని ఎలక్ట్రాన్ విన్యాసము 2, 8, 8, 2. మొదటి కర్పరంలో 2, రెండవ కర్పరంలో 8, మూడవ కర్పరంలో 8 ఎలక్ట్రానులు ఉంటాయి. చివరి కర్పరంలోని 2 ఎలక్ట్రానులు ఉంటాయి. ఆ 2 ఎలక్ట్రానులను లూయిస్ గుర్తు ద్వారా క్రింది విధంగా సూచించవచ్చు.
![]()
c) లిథియం :
లిథియం పరమాణు సంఖ్య (Z = 3). దీని ఎలక్ట్రాన్ విన్యాసం (2, 1). మొదటి కర్పరంలోని ఎలక్ట్రాన్ల సంఖ్య 2. రెండవ కర్పరంలోని ఎలక్ట్రాన్ల సంఖ్య 1. దీనిని లూయిస్ గుర్తు ద్వారా క్రింది విధంగా సూచించవచ్చు.
![]()
![]()
ప్రశ్న 13.
క్రింది అణువులను లూయీస్ గుర్తు ద్వారా సూచించండి. (AS5)
a) బ్రోమిన్ వాయువు (Br2)
b) కాల్షియం క్లోరైడ్ (CaCl2)
c) కార్బన్ డై ఆక్సెడ్ (CO2)
d) పై మూడు అణువులలో ఏది ద్విబంధం కలిగి ఉంటుంది?
జవాబు:
a) బ్రోమిన్ వాయువు (Br2):
![]()
b) కాల్షియం క్లోరైడ్ (CaCl2) :
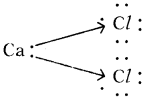
c) కార్బన్ డై ఆక్సైడ్ (CO2):

d) CO2 నందు ద్విబంధం కలదు.
ప్రశ్న 14.
నైట్రోజన్ మరియు హైడ్రోజన్ చర్య పొంది అమ్మోనియా ఏర్పరుస్తుంది.
కార్బన్, హైడ్రోజన్లతో బంధంలో పాల్గొని (CH4) మీథేన్ అణువు ఏర్పరుస్తుంది.
పైన తెల్పబడిన రెండు చర్యలలో
ఎ) చర్యలో పాల్గొన్న ప్రతి పరమాణువు యొక్క వేలన్సీ ఎంత? (AS1)
బి) ఏర్పడిన పదార్థాల యొక్క రసాయన ఫార్ములా ఏమిటీ.? (AS5)
జవాబు:
ఎ) నైట్రోజన్ మరియు హైడ్రోజన్ చర్య పొంది అమ్మోనియా (NH3) ను ఏర్పరుచును.
ఇందులో నైట్రోజన్ వేలన్సీ – 3; హైడ్రోజన్ వేలన్సీ – 1
కార్బన్, హైడ్రోజన్తో బంధంలో పాల్గొని మీథేన్ (CH4) అణువును ఏర్పరచును.
ఇందులో కార్బన్ వేలన్సీ – 4; హైడ్రోజన్ వేలన్సీ – 1
బి) 1) నైట్రోజన్, హైడ్రోజన్ తో చర్యనొంది అమ్మోనియాను ఏర్పరచును.
N2 + 3H2 → 2NH3
2) కార్బన్, హైడ్రోజన్ తో చర్యనొంది మీథేన్ ను ఏర్పరుచును.
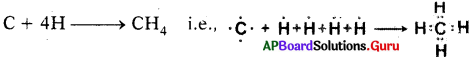
ప్రశ్న 15.
లూయిస్ చుక్కల నిర్మాణం, పరమాణువుల మధ్య బంధం ఏర్పడే విధానాన్ని అవగాహన చేసుకోవడంలో ఏ విధంగా ఏర్పడుతుంది? (AS6)
(లేదా)
అణువులు ఏర్పాటును అర్థం చేసుకోవడంలో లూయీస్ చుక్కల నిర్మాణం యొక్క పాత్రను నీవెలా అభినందిస్తావు?
జవాబు:
- మూలక పరమాణువు యొక్క వేలన్సీ ఎలక్ట్రానులను పట రూపంలో చూపించే పద్ధతి లూయిస్ చుక్కల నిర్మాణం.
- పరమాణు కేంద్రకాన్ని లోపలి క్యలోని ఎలక్ట్రాన్లను. ఆ మూలకం యొక్క గుర్తు ద్వారా మరియు పరమాణు బాహ్యకక్ష్యలోని ఎలక్ట్రాన్లను చుక్కలతో (.) లేదా క్రాస్ గుర్తు (x) తో సూచించే పద్ధతిని ‘లూయిస్ గుర్తు’ లేదా ‘లూయిస్ ఎలక్ట్రాన్ చుక్కల నిర్మాణం’ అంటారు.
- లూయిస్ ఎలక్ట్రాన్ చుక్కల నిర్మాణం ద్వారా మూలకపు వేలన్సీ కర్షరంలో ఎన్ని ఎలక్ట్రానులు ఉన్నాయో తెలుసుకోవచ్చు.
- దీని వల్ల మూలక పరమాణువు అయానిక బంధంలో పాల్గొంటుందా, సమయోజనీయ బంధంలో పాల్గొంటుందా అనే విషయాన్ని తెలుసుకోవచ్చు.
ప్రశ్న 16.
అష్టక సిద్ధాంతం అనగానేమి? మూలకాల రసాయన ధర్మాలను వివరించడంలో అష్టక సిద్ధాంతం యొక్క పాత్రను నీవు ఎలా అభినందిస్తావు? (AS5)
(లేదా)
మూలకాల రసాయన ధర్మాలను వివరించుటలో అష్టక నియమం యొక్క పాత్రను నీవెలా అభినందిస్తావు?
జవాబు:
అష్టక నియమం :
మూలకాలకు చెందిన పరమాణువులు తమ బాహ్య కక్ష్యలో ఎనిమిది ఎలక్ట్రాన్లు మిగిలి ఉండేలా రసాయనిక మార్పు చెందటానికి ప్రయత్నిస్తాయి.
- అయాను లేక పరమాణువు అనేది తన చివరి కర్పరంలో 8 ఎలక్ట్రానులు కలిగి ఉండి స్థిరత్వం కొరకు ప్రయత్నం చేయడం వలన రసాయన బంధం అనే ప్రక్రియ ద్వారా చాలా అణువులు ఏర్పడటానికి మార్గం సుగమమయింది.
- పరమాణువులు కొంత శక్తిని కోల్పోయి అణువులుగా మారి స్థిరత్వం పొందటానికి అష్టక నియమమే కారణం.
- మూలకాలు రసాయనికంగా చురుకుగా ఉండేవి తమ చివరి కర్పరంలో 8 ఎలక్ట్రానులను కలిగి ఉండవు.
- మూలకాలు చివరి కర్పరంలో అష్టకాన్ని పొంది స్థిరత్వాన్ని పొందుతాయి.
ప్రశ్న 17.
ఈ క్రింది అణువులు ఏర్పడే విధానంను వేలన్సీ బంధ సిద్దాంతం ఆధారంగా వివరించండి. (AS1)
a) N2 అణువు b) O2 అణువు
(లేదా)
వేలన్సీ బంధ సిద్ధాంతం పరముగా N2, O2 అణువులు ఏర్పడు విధానంను వివరించుము.
జవాబు:
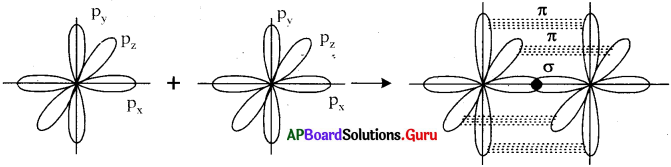
a) N, అణువు ఏర్పడే విధానం – వేలన్సీ బంధ సిద్ధాంతం ఆధారంగా :
- నైట్రోజన్ యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2px¹ 2py¹ 2pz¹.
- ఒక నైట్రోజన్ పరమాణువులోని px ఆర్బిటాల్, మరొక నైట్రోజన్ పరమాణువులోని px ఆర్బిటాల్ తో అక్షంపై అతిపాతం చెందడం వల్ల (px – px) σ బంధం ఏర్పడుతుంది.
- రెండు పరమాణువులలో మిగిలిన py, py ఆర్బిటాళ్ళు మరియు pz, pz ఆర్బిటాళ్ళు పార్శ్వ అతిపాతం చెందడం వలన రెండు π బంధాలు ఏర్పడతాయి.
- ఫలితంగా రెండు నైట్రోజన్ పరమాణువుల మధ్య 3 బంధాలతో నైట్రోజన్ అణువు ఏర్పడుతుంది.
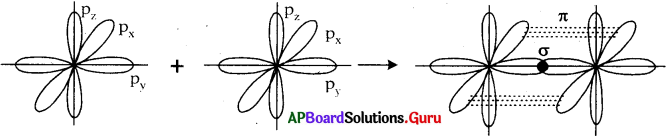
b) O2 అణువు ఏర్పడుట :
- ఆక్సిజన్ పరమాణువు యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2px¹ 2py¹ 2pz¹.
- ఆక్సిజన్ పరమాణువులోని py ఆర్బిటాల్, మరొక ఆక్సిజన్ పరమాణువులోని py ఆర్బిటాల్ లో అక్షీయరేఖ వెంబడి అతిపాతం చెందడం వల్ల (py – py) σ బంధం ఏర్పడుతుంది.
- రెండు పరమాణువులలో మిగిలిన pz pz ఆర్బిటాళ్ళు పార్శ్వ అతిపాతం చెందడం వలన (pz – pz) π బంధం ఏర్పడుతుంది.
- ఫలితంగా రెండు ఆక్సిజన్ పరమాణువుల మధ్య 2 బంధాలతో ఆక్సిజన్ అణువు ఏర్పడుతుంది.
ప్రశ్న 18.
సంకరీకరణం అనగానేమి? సంకరీకరణం ఆధారంగా ఈ క్రింది అణువులు ఏర్పడే విధానంను వివరించండి. (AS1)
a) BeCl2 అణువు b) BF3 అణువు
(లేదా)
సంకరీకరణంను నిర్వచించి, దీని ఆధారంగా ఏవైనా రెండు అణువులు ఏర్పడు విధానంను వివరించుము.
(లేదా)
సంకరీకరణం ఆధారంగా బోరాన్ ట్రై ఫ్లోరైడ్ అణువు ఏర్పడుటను వివరించండి.
జవాబు:
సంకరీకరణం :
పరమాణువుల చివరి కక్ష్యలో ఉండే దాదాపు సమాన శక్తి గల పరమాణు ఆర్బిటాళ్ళు పరస్పరం కలిసిపోయి, పునర్వ్యవస్థీకరించబడడం ద్వారా అదే సంఖ్యలో బంధశక్తి, ఆకారం వంటి ధర్మాలు ఒకే విధంగా ఉండే సర్వసమాన ఆర్బిటాళ్ళను ఏర్పరచే దృగ్విషయాన్ని సంకరీకరణం (hybridization) అంటారు.
a) సంకరీకరణము ఆధారంగా BeCl2 అణువు ఏర్పడుట :
- బెరీలియం (4Be) యొక్క భూస్థాయి ఎలక్ట్రాన్ విన్యాసం 1s² 2s²
- ఉత్తేజిత స్థితిలో దాని ఎలక్ట్రాన్ విన్యాసము 1s² 2s¹ 2px¹గా మారుతుంది.
- క్లోరిన్ పరమాణువు (17Cl ) యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2p6 3s² 3px¹ 3py¹ 3pz¹.
- బెరీలియం పరమాణువు ఉత్తేజిత స్థితిలో ఉన్నప్పుడు దానిలోని జత కూడని ఒంటరి ఎలక్ట్రాన్లను కలిగి ఉన్న 2s ఆర్బిటాల్ మరియు 2px ఆర్బిటాళ్ళను పరస్పరం కలిసిపోయి (intermix) పునర్వ్యస్థీకరించబడటం ద్వారా రెండు సర్వసమానమైన ఆర్బిటాళ్ళు ఏర్పడతాయి.
- హుండ్ నియమం ప్రకారం, సంకరీకరణం ద్వారా ఏర్పడిన ప్రతి ఆర్బిటాల్ ఒక ఎలక్ట్రాన ను కలిగి ఉంటుంది.
- సంకరీకరణంలో పాల్గొన్న ఆర్బిటాళ్ళ రకాలను బట్టి ఏర్పడిన ఈ నూతన ఆర్బిటాళ్ళను sp ఆర్బిటాళ్ళు అంటాం.
- రెండు sp ఆర్బిటాళ్ళ మధ్య బంధకోణం 180°గా ఉంటుంది.
- బెరీలియంతో బంధంలో పాల్గొనే రెండు క్లోరిన్ పరమాణువులలో ప్రతి క్లోరిన్ పరమాణువు యొక్క 3pz¹ ఆర్బిటాల్, బెరీలియం యొక్క sp సంకర ఆర్బిటాల్ తో పటంలో చూపినట్లు అతిపాతం చెందటం వలన రెండు సర్వసమానమైన Be-Cl సిగ్మా బంధాలు (σ sp-p బంధాలు) ఏర్పడతాయి.
- అందుకే ClBECl బంధకోణం 180° గా ఉండే సమాన బలాలు గల రెండు బంధాలు ఏర్పడతాయి.

b) సంకరీకరణము ఆధారంగా BF, అణువు ఏర్పడుట :
- బోరాన్ పరమాణువు (5B) యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2px¹.
- బోరాన్ పరమాణువు (5B) ఉత్తేజిత స్థితిలోనికి వెళ్ళినపుడు దాని ఎలక్ట్రాన్ విన్యాసం 1s² 2s¹ 2px¹ 2py¹ గా మారుతుంది.
- BF3 అణువులోని బోరాన్ పరమాణువు మూడు ఫ్లోరిన్ (9F) పరమాణువులతో కలిసి మూడు సమానమైన B-F బంధాలను ఏర్పరుస్తుంది.
- ఇలా జరగడానికి కారణం బోరాన్ ఉత్తేజిత స్థితిలో సంకరీకరణం చెందటం అని చెప్పవచ్చు.
- ఉత్తేజిత స్థితిలో ఉన్నప్పుడు బోరాన్ పరమాణువులో ఉండే 2s, 2px, 2py ఆర్బిటాళ్ళు పరస్పరం కలిసిపోయి, అపునర్వ్యవస్థీకరణ వలన సర్వసమానమైన మూడు sp² సంకర ఆర్బిటాళ్ళుగా ఏర్పడతాయి.
- ఈ మూడు sp² సంకర ఆర్బిటాళ్ళ మధ్య కనీస వికర్షణ ఉండటం వలన ఏ రెండు సంకర ఆర్బిటాళ్ళ మధ్యనైనా బంధకోణం 120° ఉంటుంది.
- ప్రతి sp² సంకర ఆర్బిటాల్ లో ఒక ఎలక్ట్రాన్ ఉంటుంది.
- ఫ్లోరిన్ ఎలక్ట్రాన్ విన్యాసం (9F)-1s²2s²2px² 2py² apz¹అని మనకు తెలుసు.
- బోరాన్ యొక్క మూడు sp² సంకర ఆర్బిటాళ్ళు, మూడు ఫ్లోరిన్ పరమాణువులలో ఉండే 2pz ఆర్బిటాళ్ళలోని ఒంటరి ఎలక్ట్రాన్లతో జతకూడి, మూడు σsp²-p బంధాలను ఏర్పరుస్తాయి.

ఖాళీలను పూరించండి
1. ఒక పరమాణువు బాహ్య కక్ష్యలో గల ఎలక్ట్రానులను ……………………… అంటారు. (చిట్టచివరి)
2. జడవాయువులలో వేలన్సీ కక్ష్యలో ‘8’ ఎలక్ట్రాన్లను లేని మూలకం …………… (హీలియం)
3. మూలకాల “సంయోజకత” అనేది ఒక పరమాణువు ఏర్పరచే …………….. యొక్క సంఖ్యను తెలుపుతుంది. (సమయోజనీయ బంధాల)
4. వేలన్సీ బంధ సిద్ధాంతంను ప్రతిపాదించిన శాస్త్రవేత్త …………. (సిట్టివిక్ మరియు పావెల్)
5. వేలన్సీ ఎలక్ట్రానులను రెండు పరమాణువుల మధ్య పంచుకోవడం వల్ల …… ……. బంధం ఏర్పడుతుంది. (సమయోజనీయ)
సరైన సమాధానాన్ని ఎన్నుకోండి
1. కింది వాటిలో ఏది ఋణవిద్యుదాత్మక గల మూలకం ఏది?
A) సోడియం
B) ఆక్సిజన్
C) మెగ్నీషియం
D) కాల్సియం
జవాబు:
B) ఆక్సిజన్
2. ఒక మూలకం 11X23 ‘Y’ అనే మూలకంతో అయానిక బంధం ఏర్పరచును. అయితే ‘X’ చే ఏర్పడే అయాన్ పై గల ఆవేశం …….
A) +1
B) +2
C) -1
D) -2
జవాబు:
A) +1
![]()
3. ‘A’ అనే మూలకం ACl4 ను ఏర్పర్చును. A యొక్క వేలన్సీ కక్ష్యలో గల ఎలక్ట్రానుల సంఖ్య
A) 1
B) 2
C) 3
D) 4
జవాబు:
D) 4
4. బాహ్యస్థాయిలో అష్టక విన్యాసం లేని జడవాయు మూలకం?
A) హీలియం
B) ఆర్గాన్
C) క్రిప్టాన్
D) రెడాన్
జవాబు:
A) హీలియం
5. మీథేన్ అణువులో గల సమయోజనీయ బంధాల సంఖ్య …….
A) 1
B) 2
C) 3
D) 4
జవాబు:
D) 4
6. పరమాణు ఆర్బిటాళ్ళ సంకరీకరణ భావనను ప్రవేశపెట్టినది …………..
A) లైనస్ పౌలింగ్
B) మోస్లే
C) లూయీ
D) కోసల్
జవాబు:
A) లైనస్ పౌలింగ్
7. బెరీలియం క్లోరైడ్ లో బంధ కోణం విలువ ………
A) 180°
B) 120°
C) 110°
D) 104.31
జవాబు:
A) 180°
10th Class Physical Science 8th Lesson రసాయన బంధం Textbook InText Questions and Answers
10th Class Physical Science Textbook Page No. 157
ప్రశ్న 1.
మూలకాలు ఏ స్థితిలో ఉంటాయి?
జవాబు:
ఒంటరి పరమాణువులుగా లేక కొన్ని పరమాణువుల సమూహంగా ఉంటాయి.
ప్రశ్న 2.
మూలకాలు ఒంటరి పరమాణువులుగా ఉంటాయా? లేక కొన్ని పరమాణువుల సమూహంగా ఉంటాయా?
జవాబు:
మూలకాలు కొన్ని ఒంటరి పరమాణువులుగా ఉంటాయి. మరికొన్ని పరమాణువులు సమూహంగా ఉంటాయి.
ప్రశ్న 3.
పరమాణువులుగా లభ్యమయ్యే మూలకాలు ఏమైనా ఉన్నాయా?
జవాబు:
ఉన్నాయి. ఉదా : He, Ne, Ar.
ప్రశ్న 4.
నీటి యొక్క రసాయన సాంకేతికం ఎందుకు H2గా ఉంటుంది? ఎందుకు HO2 గా ఉండదు? సోడియం క్లోరైడ్ సాంకేతికం Nacl గా ఎందుకు ఉండాలి? NaCl2 గా ఎందుకు ఉండకూడదు?
జవాబు:
అణువులో పాల్గొనే పరమాణువుల వేలన్సీలే కారణం.
![]()
ప్రశ్న 5.
ఎందుకు కొన్ని పరమాణువులు మాత్రమే సంయోగం చెందుతాయి? ఎందుకు కొన్ని పరమాణువులు సంయోగం చెందవు?
జవాబు:
ఏ పరమాణువుకు చివరి కర్పరంలో 8e– లు ఉంటాయో అవి మాత్రమే సంయోగం చెందవు. మిగిలిన పరమాణువులు సంయోగం చెందుతాయి.
10th Class Physical Science Textbook Page No. 158
ప్రశ్న 6.
మూలకాలు మరియు సమ్మేళనాలు విడివిడి పరమాణువులను ప్రక్కప్రక్కన అమర్చడం వలన ఏర్పడినాయా?
జవాబు:
- మూలకాలు ఒకే రకమైన పరమాణువుల మధ్య బంధం ఏర్పడుట వలన ఏర్పడతాయి.
- వేర్వేరు మూలక పరమాణువులు సంయోగం చెందటం వలన సమ్మేళనాలు ఏర్పడతాయి.
ప్రశ్న 7.
అలాంటి పరమాణువుల మధ్య ఏదైనా ఆకర్షణ బలం ఉందా?
జవాబు:
ఉంది.
ప్రశ్న 8.
పరమాణువులను బంధించి ఉంచేది ఏమిటి?
జవాబు:
పరమాణువులను బంధించి ఉంచేది పరమాణువుల మధ్య ఉండే విద్యుత్ ఆకర్షణ బలం.
10th Class Physical Science Textbook Page No. 159
ప్రశ్న 9.
ఎందుకు కొన్ని రసాయన చర్యలలో శక్తి గ్రహించబడటం, మరికొన్ని చర్యలలో శక్తి విడుదల అవడం జరుగుతుంది?
జవాబు:
క్రియాజనకాల, క్రియాజన్యాల బంధ శక్తులలో తేడా వలన శక్తి గ్రహించటం లేదా శక్తి విడుదలవటం జరుగును.
ప్రశ్న 10.
ఆ గ్రహించబడిన శక్తి ఎక్కడకు పోతుంది?
జవాబు:
అణువులోని పరమాణువుల మధ్య ఉండే రసాయన బంధాలను విచ్చిన్నం చేయడానికి వినియోగపడును.
ప్రశ్న 11.
శక్తి మార్పులకు, రసాయన బంధాల ఏర్పాటుకు ఏదైనా సంబంధం ఉందా?
జవాబు:
శక్తి మార్పులకు, రసాయన బంధాల ఏర్పాటుకు సంబంధం ఉంది.
ప్రశ్న 12.
మూలకాల చర్యాశీలతలో తేడాలకు కారణం ఏమై ఉండవచ్చు?
జవాబు:
చివరి కర్పరంలో ఉండే ఎలక్ట్రాన్ల సంఖ్య.
![]()
ప్రశ్న 13.
సున్న గ్రూపుకు చెందిన జడవాయువులు మిగతా మూలకాలతో పోలిస్తే విభిన్న ధర్మాలను కలిగి ఉంటాయి. దీనికి కారణం ఏమై ఉండవచ్చు?
జవాబు:
వాటి చివరి కర్పరంలో ఎనిమిది ఎలక్ట్రానులను కలిగి ఉండటం.
10th Class Physical Science Textbook Page No. 161
ప్రశ్న 14.
జడవాయువుల లూయిస్ చుక్క నిర్మాణానికి, పట్టిక – 2 లో సూచించిన మూలకాల ఎలక్ట్రాన్ విన్యాసాల మధ్య ఏం తేడా గమనించారు?
జవాబు:
ఒక్క హీలియం (He) పరమాణువుకు తప్ప మిగిలిన అన్ని జడవాయు మూలకాలకు చివరి కర్పరంలో 8 ఎలక్ట్రాన్లు ఉన్నాయి.
10th Class Physical Science Textbook Page No. 163
ప్రశ్న 15.
ప్రధాన గ్రూపులకు చెందిన మూలకాలకు సంబంధించి పైన వివరించిన సాధారణీకరణాల ద్వారా మీరేం గమనించారు?
జవాబు:
- లోహాలలో కోల్పోవడానికి సిద్ధంగా ఉన్న ఎలక్ట్రానుల సంఖ్యే వాటి వేలన్సీ.
- అలోహాలలో స్వీకరించడానికి సిద్ధంగా ఉన్న ఎలక్ట్రానుల సంఖ్యే వాటి వేలన్సీ.
ప్రశ్న 16.
మూలక పరమాణువులు ఎందుకు అణువులుగా సంయోగం చెందుతాయి?
జవాబు:
కొంత శక్తిని కోల్పోయి స్థిరత్వం పొందటానికి మరియు స్థిరమైన ఎలక్ట్రాన్ విన్యాసం పొందటానికి.
ప్రశ్న 17.
రసాయన చర్యలు జరిగేటప్పుడు IA గ్రూప్ నుండి IIIA గ్రూప్ వరకు గల మూలకాలు వాటి అయానుల రూపంలో ఉన్నప్పుడు వాని చివరి కక్ష్యలో జడవాయు పరమాణువులను పోలిన విధంగా ‘8’ ఎలక్ట్రాన్లు ఉండటం కేవలం యాదృచ్చికమా?
జవాబు:
కాదు.
10th Class Physical Science Textbook Page No. 167
ప్రశ్న 18.
ఘనస్థితిలో గల అయానిక పదార్థంలో కాటయాన్లు, ఆనయాన్లు ఎలా అమరి ఉంటాయి?
జవాబు:
స్ఫటిక రూపంలో అమరి ఉంటాయి.
ప్రశ్న 19.
సోడియం క్లోరైడ్ స్పటికంలో Na+ మరియు Cl– అయానులు జతలుగా ఉంటాయని మీరు భావిస్తున్నారా?
జవాబు:
లేదు.
10th Class Physical Science Textbook Page No. 168
ప్రశ్న 20.
ధన విద్యుదాత్మకత, ఋణవిద్యుదాత్మకత అంశాలను వివరించడానికి కారణాలు చెప్పగలరా?
జవాబు:
రెండు మూలకాలకు చెందిన పరమాణువులు అయానిక బంధంలో పాల్గొనాలంటే వాటి మధ్య ఋణవిద్యుదాత్మకతల తేడా 1.9 గానీ, అంతకంటే ఎక్కువగానీ ఉండాలి.
10th Class Physical Science Textbook Page No. 172
ప్రశ్న 21.
బంధదూరాలు, బంధశక్తుల నుండి మీరేం అర్థం చేసుకున్నారు?
జవాబు:
బంధదూరాలు, బంధశక్తుల విలువలు పరమాణువుల జంటలు మారినప్పుడు వేరువేరుగా ఉన్నాయి.
![]()
ప్రశ్న 22.
వేరు వేరు పరమాణువుల మధ్య బంధం ఏర్పడేటప్పుడు విలువలు సమానంగా ఉంటాయా?
జవాబు:
ఉంటాయి. (వేలన్సీ ఎలక్ట్రాన్ సిద్ధాంతం ప్రకారం)
10th Class Physical Science Textbook Page No. 175
ప్రశ్న 23.
ఒక అణువులో బంధకోణం అంటే ఏమిటి?
జవాబు:
సమయోజనీయ బంధంలో పాల్గొనే పరమాణువుల కేంద్రకాల గుండా వెళ్ళే ఊహారేఖలు, మధ్య పరమాణువు కేంద్రం వద్ద చేయుకోణంను ‘బంధకోణం’ అంటారు.
10th Class Physical Science Textbook Page No. 157
ప్రశ్న 24.
ఎందుకు కొన్ని మూలకాలు పరమాణువులుగా, మరికొన్ని అణువులుగా ఉంటాయి?
జవాబు:
- సున్న గ్రూప్ మూలకాలకు వేలన్స్ ఆర్బిటాల్ లో 2 లేదా 8 ఎలక్ట్రాన్లుండటం వల్ల స్థిరంగా, పరమాణువులుగా ఉంటాయి.
- మిగతా పరమాణువులు, ఎలక్ట్రాన్లను కోల్పోవటం గాని, గ్రహించటం గాని, లేదా పంచుకోవడం గాని గావించి అణువులనేర్పరుస్తాయి.
ప్రశ్న 25.
ఎందుకు కొన్ని మూలకాల సమ్మేళనాలు ఎక్కువ చర్యాశీలత కలిగి ఉంటాయి ? ఎందుకు కొన్ని జడపదార్థాలుగా ఉంటాయి?
జవాబు:
- వాటి చివరి కర్పరంలో ఉండే ఎలక్ట్రాన్ల సంఖ్య.
- సమ్మేళనాలలోని పరమాణువుల మధ్య బంధశక్తి.
10th Class Physical Science Textbook Page No. 176
ప్రశ్న 26.
HCl అణువు ఎలా ఏర్పడుతుంది?
జవాబు:
H పరమాణువులో ఒంటరి ఎలక్ట్రానను కలిగి ఉన్న ‘1s’ ఆర్బిటాల్, క్లోరిన్ పరమాణువు యొక్క వ్యతిరేక స్పినను కలిగి ఉన్న ఒంటరి ఎలక్ట్రాన్ ను కలిగి ఉన్న ‘3p’ ఆర్బిటాల్ తో అతిపాతం చెందటం మూలంగా HCl ఏర్పడుతుంది.
10th Class Physical Science Textbook Page No. 177
ప్రశ్న 27.
బెరీలియం పరమాణువు ఒక్కొక్క క్లోరిన్ పరమాణువుతో ఒక బంధం చొప్పున రెండు సమయోజనీయ బంధాలను ఏర్పరుచుతుంది. ఇది ఏ విధంగా సాధ్యపడునో ఊహించగలరా?
జవాబు:
బెరీలియం పరమాణువు భూస్థాయి ఎలక్ట్రాన్ విన్యాసం 1s² 2s² ఉత్తేజిత స్థితిలో దాని ఎలక్ట్రాన్ విన్యాసం 1s²2s¹2py¹ గా మారుతుంది. అందువలన రెండు క్లోరిన్ పరమాణువులతో ఒక్కొక్క బంధం చొప్పున రెండు సమయోజనీయ బంధాలను ఏర్పరచటం సాధ్యపడుతుంది.
10th Class Physical Science Textbook Page No. 178
ప్రశ్న 28.
బోరాన్ పరమాణువు ఒక సంయోజనీయ బంధాన్ని మాత్రమే కలిగి ఉండే B – F అనే అణువును ఏర్పరచాలి. కానీ ప్రయోగాత్మకంగా BF3 అణువు ఏర్పడుతుంది. దీనికి కారణమేమై ఉంటుందో మీరు ఊహించగలరా?
జవాబు:
బోరాన్ పరమాణువు భూస్థాయి ఎలక్ట్రాన్ విన్యాసం 1s²2s²2px¹ ఉత్తేజిత స్థితిలో దాని ఎలక్ట్రాన్ విన్యాసం 1s²2s¹2px¹2py¹గా మారుతుంది. అందువల్ల BF3 అణువు ఏర్పడుతుంది.
![]()
పరికరాల జాబితా
రసాయన సమ్మేళనాలకు సంబంధించిన చార్టులు, ఫ్లాష్ కార్డులు, బాల్ మరియు స్టిక్ మోడల్స్.
10th Class Physical Science 8th Lesson రసాయన బంధం Textbook Activities
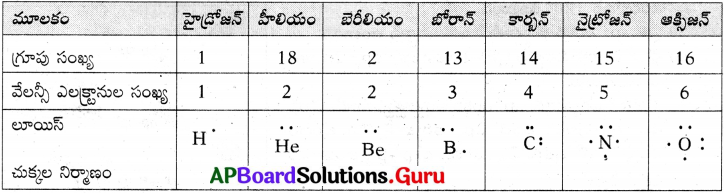
1. కింది పట్టికలో ఇవ్వబడిన మూలకాలకు లూయిస్ నిర్మాణాలను వ్రాయండి. ఆవర్తన పట్టికను పరిశీలించి, . క్రింది మూలకాలు ఏ గ్రూపుకు చెందుతాయో గుర్తించండి.
జవాబు: