AP State Syllabus 10th Class Physical Science 7th Lesson Questions and Answers మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక
10th Class Physical Science 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక Textbook Questions and Answers
అభ్యసనాన్ని మెరుగుపరుచుకోండి
ప్రశ్న 1.
మెండలీవ్ ఆవర్తన పట్టికలోని లోపాలు ఏవి ? నవీన ఆవర్తన పట్టిక, మెండలీవ్ పట్టికలోని చాలా లోపాలను ఎలా తొలగించగలిగింది? (AS1)
(లేదా)
మెండలీవ్ ఆవర్తన పట్టికలోని లోపాలను నవీన ఆవర్తన పట్టిక ఏ విధముగా సవరించినవో వివరించుము.
జవాబు:
మెండలీవ్ ఆవర్తన పట్టిక – లోపాలు :
1. అసంగత మూలకాల జతలు :
అధిక పరమాణు ద్రవ్యరాశి గల మూలకాలు, అల్ప పరమాణు ద్రవ్యరాశి గల మూలకాలకు ముందు ఉన్నాయి.
ఉదా : Te (పరమాణు ద్రవ్యరాశి 127.64), I (పరమాణు ద్రవ్యరాశి 126.94) కన్నా ముందు చేర్చబడినది.
2. సారూప్యత లేని మూలకాలను కలిపి ఉంచడం :
విభిన్న ధర్మాలు గల మూలకాలను ఒకే గ్రూపులో ఉపగ్రూపు – A మరియు ఉపగ్రూపు – B లలో ఉంచారు.
ఉదా : IA గ్రూపుకు చెందిన Li, Na, K వంటి క్షారలోహాలు, IB గ్రూపుకు చెందిన Cu, Ag, Au వంటి మూలకాలతో చాలా తక్కువ సారూప్యతను కలిగి ఉంటాయి.
నవీన ఆవర్తన పట్టిక, మెండలీవ్ లోపాలను తొలగించిన విధానము :
- పరమాణు సంఖ్య ఆరోహణక్రమం ప్రకారం అసంగత మూలకాల జతలు ఉంచబడ్డాయి.
- సారూప్యత లేని మూలకాలను వేరువేరు గ్రూపులలో ఉంచడం జరిగింది.
- ఎలక్ట్రాన్ విన్యాసం పరంగా వేర్వేరు మూలకాలు వేర్వేరు గ్రూపులలో ఉంచడం జరిగినది.
ప్రశ్న 2.
నవీన ఆవర్తన నియమాన్ని నిర్వచించండి. విస్తృత ఆవర్తన పట్టిక ఏ విధంగా నిర్మించబడిందో వివరించండి. (AS1)
(లేదా)
ఆధునిక ఆవర్తన పట్టిక యొక్క అంశాలను వివరించండి.
జవాబు:
నవీన ఆవర్తన నియమము : మూలకాల భౌతిక, రసాయన ధర్మాలు వాటి ఎలక్ట్రాన్ విన్యాసాల ఆవర్తన ప్రమేయాలు.
విస్తృత ఆవర్తన పట్టిక నిర్మాణము :
- ఆవర్తన నియమము ప్రకారం నిర్మించబడినది.
- దీనినే విస్తృత ఆవర్తన పట్టిక అంటారు.
- ఈ పట్టికలో 18 నిలువు వరుసలు (గ్రూపులు), 7 అడ్డు వరుసలు (పీరియడ్లు) ఉంటాయి.
- సాంప్రదాయబద్ధంగా గ్రూపులను I నుండి VIII వరకు రోమన్ సంఖ్యలను ఉపయోగించి సూచిస్తూ వాటికి A, B అక్షరాలను జోడించి చూపుతారు.
- గ్రూపులలో ఒకే ఎలక్ట్రాన్ విన్యాసం కలిగిన మూలకాలను అమర్చారు.
- ఆవర్తన పట్టికలో 7 పీరియడ్లను 1 నుండి 7 వరకు అరబిక్ సంఖ్యలచే సూచిస్తారు.
- పీరియడ్ లో మూలకాలను పరమాణు సంఖ్యల ఆరోహణ క్రమంలో అమర్చారు.
- మూలకం యొక్క పరమాణువులో చిట్టచివరి ఎలక్ట్రాన్ లేదా భేదపరిచే ఎలక్ట్రాన్ ఏ ఉపకక్ష్యలో చేరుతుందో దానిని ఆధారంగా చేసుకుని మూలకాలను s, p, d, f బ్లాకు మూలకాలుగా వర్గీకరించారు.
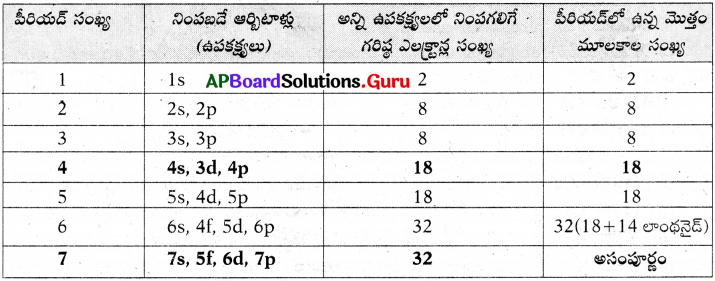
- మొదటి పీరియడ్ 2 మూలకాలను, 2వ మరియు 3వ పీరియడ్లు 8 మూలకాలను, 4వ మరియు 5వ పీరియడ్లు 18 మూలకాలను, 6వ పీరియడ్ 32 మూలకాలను మరియు 7వ పీరియడ్ అసంపూర్తిగా నిండి ఉంటాయి.
![]()
ప్రశ్న 3.
మూలకాలు ఏ విధంగా s, p, d, f బ్లాకులుగా విభజించబడ్డాయి? ఈ రకమైన వర్గీకరణ వలన ఎటువంటి అనుకూలతలున్నాయి? (AS1)
జవాబు:
మూలకం యొక్క పరమాణువులో చిట్టచివరి ఎలక్ట్రాన్ లేదా భేదపరిచే ఎలక్ట్రాన్, ఏ ఉపకక్ష్యలో చేరుతుందో దాని ఆధారముగా చేసుకుని మూలకాలను s, p, d, f బ్లాక్ మూలకాలుగా వర్గీకరించారు.
s – బ్లాకు మూలకాలు :
- ఇవి గ్రూపు IA మరియు IIA కు చెందిన మూలకాలు.
- వీటిలో భేదపరిచే ఎలక్ట్రాన్ s – ఆర్బిటాల్ లోకి
- హైడ్రోజన్ తప్ప, అన్ని s – బ్లాకు మూలకాలు లోహాలే.
- వీటి యొక్క ఎలక్ట్రాన్ విన్యాసము ns¹ నుండి ns² గా ఉండును.
p – బ్లాకు మూలకాలు :
- ఇవి గ్రూపు IIIA నుండి VIIIA కు చెందిన మూలకాలు.
- వీటిలో భేదపరిచే ఎలక్ట్రాన్ p – ఆర్బిటాల్ లోనికి చేరును.
- వీటి యొక్క ఎలక్ట్రాన్ విన్యాసము ns² np¹ నుండి ns² np6 గా ఉండును.
- p – బ్లాక్ మూలకాలలో లోహాలు, అలోహాలు మరియు అర్ధలోహాలుంటాయి.
- p- బ్లాకు మూలకాలలో He లో మాత్రమే ఎలక్ట్రాన్ p – ఆర్బిటాల్ లోనికి చేరదు.
d – బ్లాకు మూలకాలు :
- ఇవి గ్రూపు IB నుండి. VIIIB లకు చెందిన మూలకాలు. చేరును.
- వీటిలో భేదపరిచే ఎలక్ట్రాన్ d – ఆర్బిటాల్ లోనికి చేరును.
- d – బ్లాకు మూలకాలన్నీ లోహాలే.
- వీటి ఎలక్ట్రాన్ విన్యాసము (n-1) d1-10, ns1లేక2
f – బ్లాకు మూలకాలు :
- ఆవర్తన పట్టికకు క్రిందన ఉన్న లాంథనైడులు మరియు ఆక్టివైడులను కలిపి f – బ్లాకు మూలకాలు అంటారు.
- భేదపరిచే ఎలక్ట్రాన్ f – ఆర్బిటాల్ లోనికి చేరును.
- వీటిని అంతర పరివర్తన మూలకాలంటారు.
అనుకూలతలు :
- ఈ విధముగా బ్లాకులుగా విభజించడం వలన మూలకాలను తేలికగా గుర్తించగలము.
- మూలకాలను తేలికగా గ్రూపులుగా విభజించగలము
ప్రశ్న 4.
A, B, C, D మూలకాల ఎలక్ట్రాన్ విన్యాసాలను క్రింద ఇవ్వడమైనది. వీటి ఆధారంగా కింది ప్రశ్నలకు జవాబులివ్వండి. (AS1)
A. 1s² 2s² – 1. ఒకే పీరియడ్ లో ఉండే మూలకాలు ఏవి?
B. 1s² 2s² 2p6 3s² – 2. ఒకే గ్రూపులో ఇమిడి ఉన్న మూలకాలేవి?
C. 1s² 2s² 2p6 3s² 3p³ – 3. జడవాయు మూలకాలేవి?
D. 1s² 2s² 2p6 – 4. ‘C’ అనే మూలకం ఏ గ్రూపు, ఏ పీరియడ్ కు చెందినది?
జవాబు:
ఎలక్ట్రాన్ విన్యాసము ప్రకారము
A) Be
B) Mg
C) P
D) Ne మూలకాలను కలిగి ఉన్నవి.
- B మరియు C లు ఒకే పీరియడ్ కు చెందుతాయి.
- A మరియు B లు ఒకే గ్రూపుకు చెండుతాయి.
- ‘D’ మూలకము జడవాయువుకు చెందును.
- ‘C’ మూలకము 3వ పీరియడ్ మరియు 15వ గ్రూపుకు చెందును.
![]()
ప్రశ్న 5.
పరమాణు సంఖ్య 17గా గల మూలకం యొక్క క్రింది లక్షణాలను రాయండి. (AS1)
ఎలక్ట్రాన్ విన్యాసం …………………
పీరియడ్ సంఖ్య …………………
గ్రూపు సంఖ్య …………………
మూలక కుటుంబం …………………
వేలన్సీ ఎలక్ట్రాన్ల సంఖ్య …………………
సంయోజకత …………………
లోహం లేదా అలోహం …………………
జవాబు:
ఎలక్ట్రాన్ విన్యాసం : 1s² 2s² 2p6 3s² 3p5
పీరియడ్ సంఖ్య : 3
గ్రూపు సంఖ్య : VII A
మూలక కుటుంబం : హాలోజన్ కుటుంబం
వేలన్సీ ఎలక్ట్రాన్ల సంఖ్య : 2 + 5 = 7
సంయోజకత : 1
లోహం లేదా అలోహం : అలోహము
ప్రశ్న 6.
గ్రూపులో ఉండే మూలకాలు సాధారణంగా ఒకే రకమైన ధర్మాలు కలిగి ఉంటాయి. కానీ పీరియడ్ లో మూలకాలు భిన్న ధర్మాలను కలిగి ఉంటాయి. ఈ వ్యాక్యాన్ని ఎలా వివరిస్తావు? (AS1)
(లేదా)
సాధారణంగా గ్రూపులో ఉండు మూలకాలు ఒకేరకమైన ధర్మాలు కలిగి ఉంటాయి, కానీ పీరియడ్లలో ఇది భిన్నము ఎందుకో వివరించుము.
జవాబు:
- విస్తృత ఆవర్తన పట్టిక నవీన ఆవర్తన నియమంపై ఆధారపడి తయారు చేయబడినది.
- నవీన ఆవర్తన నియమం ప్రకారం మూలకాల భౌతిక, రసాయన ధర్మాలు వాటి ఎలక్ట్రాన్ విన్యాసాల ఆవర్తన ప్రమేయాలు అనగా ఒకే ఎలక్ట్రాన్ విన్యాసం కలిగిన మూలకాలు సారూప్యత కలిగి ఉంటాయి.
- గ్రూపులోని మూలకాల యొక్క పరమాణువులు ఒకే ఎలక్ట్రాన్ విన్యాసమును కలిగి ఉంటాయి. కావున మూలకాలన్నీ ఒకే రసాయన ధర్మాలను కలిగి ఉంటాయి మరియు పై నుండి క్రిందకు ఒకే భౌతిక ధర్మాలను ప్రదర్శిస్తాయి.
- పీరియడ్లలోని మూలకాల యొక్క పరమాణువులు వేర్వేరు ఎలక్ట్రాన్ విన్యాసాలను కలిగి ఉంటాయి. కావున వేర్వేరు రసాయన మరియు భౌతిక ధర్మాలను ప్రదర్శిస్తాయి.
ప్రశ్న 7.
నవీన ఆవర్తన పట్టికను ఉపయోగించి కింది పట్టికను పూర్తి చేయండి. (AS1)
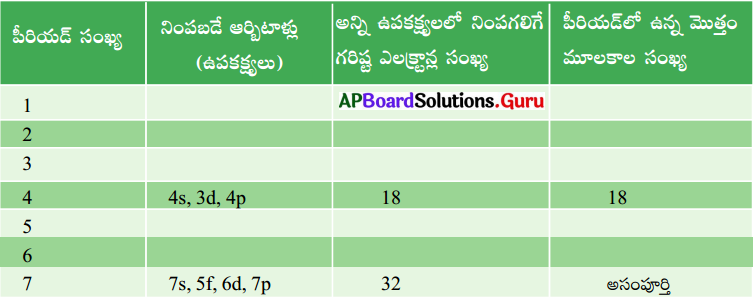
జవాబు:
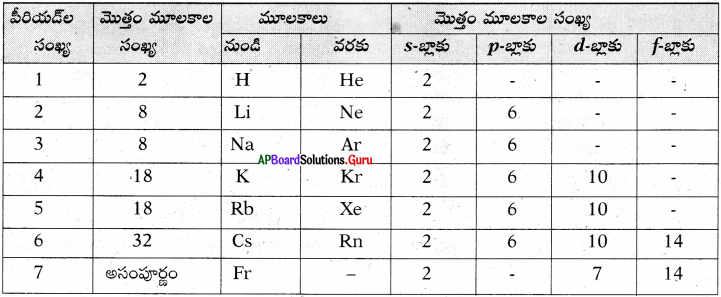
ప్రశ్న 8.
నవీన ఆవర్తన పట్టికను ఉపయోగించి కింది పట్టికను పూరించండి. (AS1)
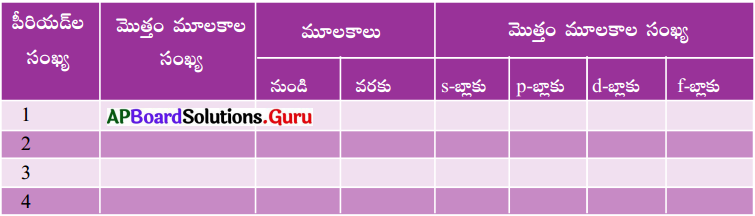
జవాబు:
ప్రశ్న 9.
X, Y, Z ల ఎలక్ట్రాను విన్యాసాలు కింది విధంగా ఉన్నాయి. (AS1)
X = 2 Y = 2, 6
Z = 2, 8, 2 వీనిలో ఏది
a) రెండవ పీరియడు చెందిన మూలకం?
b) రెండవ గ్రూపునకు చెందిన మూలకం?
c) 18వ గ్రూపునకు చెందిన మూలకం?
జవాబు:
a) ‘Y’ మూలకము రెండవ పీరియడకు చెందును.
కారణము : భేదిత ఎలక్ట్రాన్ రెండవ ఆర్బిటాల్ నందు ప్రవేశించినది కావున.
b) ‘Z’ మూలకము రెండవ గ్రూపుకు చెందును.
కారణము : దీని యొక్క సంయోజకత “2” కావున.
C) ‘X’ మూలకము 18వ గ్రూపుకు చెందును.
కారణము : ఇది పూర్తిగా నిండిన వేలన్సీ ఆర్బిటాల్ ను కలిగి ఉన్నది.
![]()
ప్రశ్న 10.
కింది జతలలో ఏ మూలకం యొక్క పరమాణు వ్యాసార్ధం ఎక్కువగా ఉండునో గుర్తించండి. (AS1)
(i) Mg లేదా Ca
(ii) Li లేదా Cs
(iii) N లేదా P
(iv) B లేదా Al (Each 1 Mark)
జవాబు:
ధర్మము : పీరియడ్ లో ఎడమ నుండి కుడికి పరమాణు వ్యాసార్ధం తగ్గును.
గ్రూపులలో పై నుండి క్రిందకు పరమాణు వ్యాసార్ధం పెరుగును.
(i) Mg లేదా Ca : ఇవి రెండూ ఒకే గ్రూపుకు చెందును. Ca కు పరమాణు వ్యాసార్ధము ఎక్కువ.
(ii) Li లేదా CS : ఇవి ఒకే గ్రూపుకు చెందును. CS కు పరమాణు వ్యాసార్ధము ఎక్కువ.
(iii) N లేదా P : ఇవి ఒకే గ్రూపుకు చెందును. P కు పరమాణు వ్యాసార్ధము ఎక్కువ.
(iv) B లేదా Al : ఇవి కూడా ఒకే గ్రూపుకు చెందినవి. AL కు పరమాణు వ్యాసార్ధము ఎక్కువ.
ప్రశ్న 11.
కింది సందర్భాలలో లోహధర్మం ఎలా మారుతుంది? (AS1)
a) గ్రూపులో కిందికి వెళ్లే కొలది
b) పీరియడ్ లో ఎడమ నుండి కుడికి వెళ్లేటప్పుడు
(లేదా)
గ్రూపుల్లో మరియు పీరియడ్లలో లోహధర్మం ఏ విధంగా మారుతుంది? వివరించుము.
జవాబు:
a) గ్రూపులో కిందికి వెళ్ళేకొలది లోహధర్మం పెరుగును.
b) పీరియడ్ లో ఎడమ నుండి కుడికి వెళ్ళే కొలదీ లోహధర్మం తగ్గుతూ, అలోహధర్మం పెరుగును.
ప్రశ్న 12.
మూలకాల వర్గీకరణ నియమం పరమాణు ద్రవ్యరాశుల నుండి పరమాణు సంఖ్యలకు ఎందుకు మారింది? (AS1)
(లేదా)
మూలకాల వర్గీకరణ నియమం పరమాణు భారాల నుండి పరమాణు సంఖ్యలకు మారుటకు గల కారణమేమిటో, వ్రాయుము.
జవాబు:
- 18వ శతాబ్దంలో లూయీస్ ప్రాస్ట్ హైడ్రోజన్ పరమాణువును ఒక నిర్మాణాత్మక ప్రమాణమని తెలిపాడు.
- ప్రాస్ట్ కాలంలోనే అన్ని మూలకాల పరమాణుభారాలను పూర్ణాంక సంఖ్యలుగా తెలుపబడ్డాయి.
- క్రీ.శ. 1829లో డాబరీనర్ అను జర్మన్ రసాయన వేత్త పరమాణు భారాలను ఆధారముగా చేసుకొని త్రిక సిద్ధాంతంను ప్రతిపాదించెను.
- క్రీ.శ. 1865లో జాన్ న్యూలాండ్స్ పరమాణుభారాలను ఆధారముగా చేసుకుని అష్టక నియమమును ప్రతిపాదించెను.
- కానీ ఈ అష్టక నియమము కాల్షియం కంటే ఎక్కువ పరమాణు ద్రవ్యరాశి ఉన్న మూలకాలకు వర్తించలేదు.
- ఆ తర్వాత మెండలీవ్ అను రష్యన్ శాస్త్రవేత్త మూలకాల పరమాణు ద్రవ్యరాశులను ఆరోహణ క్రమంలో అమర్చి ఒక పట్టికను రూపొందించారు.
- మెండలీవ్ ఆవర్తన నియమమును పరమాణుభారాల ఆధారంగా ప్రతిపాదించాడు.
- ఆ తర్వాత క్రీ.శ. 1913లో బ్రిటీష్ శాస్త్రవేత్త అయిన మోస్లే x – కిరణ స్వభావాన్ని విశ్లేషించి, మూలక పరమాణువులలో ఉండే పరమాణు సంఖ్యను కనుగొన్నాడు.
- దీనినిబట్టి ఏదైనా మూలకానికి పరమాణువుల ద్రవ్యరాశి కన్నా పరమాణు సంఖ్యయే విలక్షణమైన ధర్మమని మోస్లే ప్రతిపాదించాడు.
- పరమాణు సంఖ్యలను తెలుసుకున్న తర్వాత ఆవర్తన పట్టికలో పరమాణు సంఖ్యల ఆధారంగా మూలకాలను అమర్చడం జరిగినది.
- ఈ అమరిక ఇంతకు మునుపు అనుసరించిన పద్ధతి కన్నా మేలైనదిగా గుర్తించాడు.
- పరమాణుభారం అనే భావన నుండి పరమాణు సంఖ్య భావనకు ఆవర్తన నియమం మార్చబడి, నవీన ఆవర్తన నియమంగా పిలువబడుతుంది.
ప్రశ్న 13.
ఆవర్తన ధర్మమంటే ఏమిటి? క్రింది ధర్మాలు పీరియడ్, గ్రూపులలో ఏ విధంగా మార్పు చెందుతాయో వివరించండి. (AS1)
a) పరమాణు వ్యాసార్ధం b) అయనీకరణ శక్తి c) ఎలక్ట్రాన్ ఎఫినిటీ d) ఋణవిద్యుదాత్మకత
జవాబు:
ఆవర్తన ధర్మం : వేలన్సీ ఆర్బిటాల్ విన్యాసం ఆధారంగా మూలకాలను అమర్చినపుడు వాటి ధర్మాలు నిర్ణీత వ్యవధులలో పునరావృతమయ్యే ధర్మము.
a) పరమాణు వ్యాసార్ధము :
పరమాణు కేంద్రకం నుండి వేలన్సీస్థాయి ఎలక్ట్రానులకు మధ్య గల దూరంను పరమాణు వ్యాసార్ధము అంటారు.
- గ్రూపులలో : గ్రూపులలో పై నుండి కిందికి పోయే కొద్దీ పరమాణు వ్యాసార్ధం పెరుగుతూ ఉంటుంది.
- పీరియలో : పీరియలో ఎడమ నుండి కుడికి వెళ్లే కొలదీ పరమాణు వ్యాసార్ధం తగ్గుతూ ఉంటుంది.
b) అయనీకరణ శక్తి :
వాయుస్థితిలో ఒంటరిగా, తటస్థంగా ఉన్న పరమాణువు యొక్క బాహ్య కక్ష్య నుండి ఒక ఎలక్ట్రాను తీసివేయడానికి కావలసిన కనీస శక్తిని అయనీకరణ శక్తి అంటారు.
- గ్రూపులలో పై నుండి కిందికి పోయేకొలదీ మూలకాల అయనీకరణ శక్తి తగ్గును.
- పీరియలో ఎడమ నుండి కుడికి పోయేకొలదీ మూలకాల అయనీకరణ శక్తి పెరుగును.
c) ఎలక్ట్రాన్ ఎఫినిటీ :
వాయుస్థితిలో ఒంటరి, తటస్థ పరమాణువుకు ఒక ఎలక్ట్రాన్ ను చేర్చగా విడుదలయ్యే శక్తిని ఎలక్ట్రాన్ ఎఫినిటీ అంటారు.
- గ్రూపులలో పై నుండి కిందికి పోయేకొలదీ ఎలక్ట్రాన్ ఎఫినిటీ విలువలు క్రమముగా తగ్గుతాయి.
- పీరియడ్ లో ఎడమ నుండి కుడికి పోయేకొలదీ ఎలక్ట్రాన్ ఎఫినిటీ విలువలు క్రమముగా పెరుగుతాయి.
d) ఋణవిద్యుదాత్మకత :
ఒక మూలకపు పరమాణువు వేరే మూలక పరమాణువుతో బంధములో ఉన్నపుడు ఎలక్ట్రాన్లను తనవైపు ఆకర్షించే ప్రవృత్తిని ఆ మూలక ఋణవిద్యుదాత్మకత అంటారు.
- గ్రూపులలో పై నుండి కిందికి పోయే కొలదీ మూలకాల ఋణవిద్యుదాత్మకతలు క్రమంగా తగ్గుతాయి.
- పీరియడ్ లో ఎడమ నుండి కుడికి పోయేకొలదీ మూలకాల ఋణవిద్యుదాత్మకతలు క్రమంగా పెరుగుతాయి.
![]()
ప్రశ్న 14.
Mg ధర్మాలను పోలిన ఏవేని రెండు మూలకాలను పేర్కొనండి. ఏ ఏ అంశాల ఆధారంగా వాటిని ఊహించగలిగారు? (AS2)
జవాబు:
Mg ధర్మాలను పోలిన రెండు మూలకాలు కాల్షియం (Ca) మరియు బెరీలియం’ (Be). ఎందుకనగా,
- Be, Mg మరియు Ca లు ఒకే గ్రూపు (IIA)కు చెందిన మూలకాలు.
- ఈ మూడు మూలక పరమాణువుల బాహ్య కర్పరంలో ‘2’ ఎలక్ట్రాన్లు కలవు.
- ఈ మూడు ఒకే రసాయన ధర్మాలను ప్రదర్శిస్తాయి.
ప్రశ్న 15.
ఆవర్తన పట్టికను ఉపయోగించి 18వ గ్రూపు మూలకమైన ‘X, 16వ గ్రూపు మూలకమైన ‘Y ల మధ్య ఏర్పడిన సమ్మేళనానికి ఫార్ములాను ఊహించండి. (AS2)
జవాబు:
- X – మూలకము 13వ గ్రూపులో కలదు, కావున X యొక్క సంయోజకత విలువ 3.
- Y – మూలకము 16వ గ్రూపులో కలదు, కావున Y యొక్క సంయోజకత విలువ 2.
- X మరియు Y ల మధ్య ఏర్పడిన సమ్మేళన ఫార్ములా X2 Y3

ప్రశ్న 16.
X అనే మూలకం మూడవ పీరియడ్ కు, రెండవ గ్రూపునకు చెందినది అనుకుందాం. అయితే ఈ క్రింది ప్రశ్నలకు జవాబులివ్వండి. (AS2)
a) వేలన్సీ ఎలక్ట్రానులు ఎన్ని ఉంటాయి?
b) సంయోజకత ఎంత?
c) ఇది లోహమా? అలోహమా?
జవాబు:
‘X’ అను మూలకము మూడవ పీరియడ్ కు రెండవ గ్రూపునకు, చెందినది. కావున ఇది గ్రూపు-II కు చెందిన Mg అగును.
a) వేలన్సీ ఎలక్ట్రానుల సంఖ్య = 2
b) సంయోజకత = 2
c) ఇది ఒక లోహము.
ఈ మూలకం IIA గ్రూపకు చెందినది.
ప్రశ్న 17.
ఒక మూలకం యొక్క పరమాణు సంఖ్య 19. అయితే ఆవర్తక పట్టికలో దీని స్థానం ఏది? దాని స్థానాన్ని ఎలా చెప్పగలరు? (AS2)
జవాబు:
మూలకపు పరమాణు సంఖ్య = 19
ఎలక్ట్రానుల అమరిక = 1s² 2s² 2p6 3s² 3p64s¹ ⇒ (2,8,8,1 )
భేదిత ఎలక్ట్రాను 4వ కర్పరంలో ప్రవేశించును. కనుక మూలకం 4వ పీరియడ్ కు చెందును.
వేలన్సీ ఎలక్ట్రాన్ల సంఖ్య = 1, కావున ఇది 1వ గ్రూపుకు చెందును.
పరమాణు సంఖ్య 19కల మూలకము 4వ పీరియడ్ మరియు 1 గ్రూపుకు చెందును.
ప్రశ్న 18.
IA గ్రూపునకు చెందిన క్షార లోహాల యొక్క లోహ ధర్మాలు ఆ గ్రూపులో పై నుండి కిందికి వచ్చేటప్పుడు పెరుగుతుంది అనే అంశాన్ని బలపరచడానికి సరియైన సమాచారాన్ని సేకరించి, నివేదిక తయారు చేయండి. (AS4)
(లేదా)
IA గ్రూపు యొక్క లోహ ధర్మం గూర్చి సమాచారాన్నిమ్ము.
జవాబు:
- ఏదైనా మూలకము ఎలక్ట్రానులను కోల్పోయి ధనాత్మక అయానులుగా ఏర్పడే స్వభావంను లోహ స్వభావం అంటారు.
- IA గ్రూపు మూలకాలు Li, Na, K, Rb, Cs.
- ఆవర్తన పట్టికలో ఎడమవైపున ఉన్న మూలకాలు (IA గ్రూపు మూలకాలు) ఎలక్ట్రానులను కోల్పోయే తత్వం కలవి. అందుకనే వీటిని బలమైన లోహాలు అంటారు. వీటికి చర్యాశీలత ఎక్కువ.
- గ్రూపులలో పై నుండి కిందికి వెళ్లే కొలది పరమాణు పరిమాణం పెరుగును.
- బాహ్య కక్ష్యలో ఎలక్ట్రాన్లు తక్కువ కేంద్రక ఆకర్షణ కలిగి ఉండటం వలన అవి తేలికగా ఎలక్ట్రానులను కోల్పోతాయి. అందువలన లోహ స్వభావం పెరుగును.
- అయనీకరణ శక్తి Li నుండి CS వరకు తగ్గును.
- Li నుండి CS వరకు పరమాణు వ్యాసార్ధం పెరుగును. కనుక లోహ స్వభావం పెరుగును.
ప్రశ్న 19.
పరమాణు ఎలక్ట్రాన్ విన్యాసం గురించిన విషయాలు అప్పటివరకు ఇంకా కనుగొననప్పటికీ మెండలీవ్ తన ఆవర్తన పట్టికలో మూలకాలను దాదాపుగా విస్తృత ఆవర్తన పట్టికలోని అమరికకు దగ్గరగా అమర్చగలిగాడు. అతని కృషిని మీరెలా అభినందిస్తారు? (AS6)
(లేదా)
మూలకాల వర్గీకరణలో మెండలీవ్ యొక్క పాత్రను నీవెలా అభినందిస్తావు?
జవాబు:
- మెండలీవ్ మూలకాలను వాటి పరమాణుభారాల ఆధారంగా అమర్చాడు.
- మెండలీవ్ తన ఆవర్తన పట్టికలో, అప్పటి వరకు తెలిసిన మూలకాలను 8 నిలువు వరుసలలో అమర్చాడు. వీటిని గ్రూపులన్నాడు.
- ఈ గ్రూపులలోని మూలకాలన్నీ ఒకే రకమైన ధర్మాలను కలిగి ఉంటాయి.
- తన పట్టికలోని అడ్డు వరుసలను పీరియడ్లని, వీటిలోని మూలకాలన్నింటిలోనూ ఒకే రకమైన ధర్మాలు పునరావృతమవుతూ ఉంటాయని తెలిపాడు.
- ఇతను తన పట్టికలో అప్పటికి లభ్యంకాని మూలకాల ధర్మాలను ముందే ఊహించి వాటికి తాత్కాలిక పేర్లు పెట్టాడు. వాటికి కొన్ని స్థానాలను కేటాయించాడు.
- మెండలీవ్ పట్టికలో మూలకాలను సరైన స్థానంలో ఉంచడం ద్వారా కొన్ని మూలకాల యొక్క పరమాణు ద్రవ్యరాశిని సరిచేయుటకు వీలు కలిగింది.
- మెండలీవ్ పాటించిన ఇలాంటి అసాధారణ ఆలోచనా విధానం, మిగిలిన రసాయన శాస్త్రవేత్తలందరినీ మెండలీవ్ ఆవర్తన పట్టికను అంగీకరించేలా, గుర్తించేలా సహాయపడింది.
- మెండలీవ్ ఆవర్తన పట్టిక, ఆయన ప్రతిపాదించిన ఆవర్తన నియమానికి గొప్ప గుర్తింపు లభించింది.
- ఈ విధముగా, అప్పట్లో ఎలక్ట్రాను విన్యాసము తెలియకపోయినా మెండలీవ్ వేలన్సీ ఆధారంగా మూలకాలను అమర్చగలిగాడు. ఆ పట్టిక విస్తృత ఆవర్తన పట్టికను పోలి ఉంది. ఇంతటి కృషి చేసిన మెండలీవ్ ను అభినందించక . తప్పదు.
ప్రశ్న 20.
ఆవర్తన పట్టికలో హైడ్రోజన్ యొక్క స్థానంపై మీ వాదనను రాయండి. (AS7)
జవాబు:
- హైడ్రోజన్ మిగిలిన మూలకాల కన్నా తేలికైన పరమాణు నిర్మాణం గల మూలకము.
- హైడ్రోజన్ ఎలక్ట్రాన్ విన్యాసము 1s¹. దీనిలో ఒక ప్రోటాను కేంద్రకంలో మరియు ఒక ఎలక్ట్రాను 1s ఆర్బిటాల్ లో ఉన్నది.
- ఈ ఎలక్ట్రాన్ విన్యాసముతో హైడ్రోజన్ యొక్క స్థానం ఆవర్తన పట్టికలో IA లేదా VIIA గ్రూపులో ఉండవచ్చును.
- హైడ్రోజన్ ధర్మాలు క్షారలోహాలు (IA) మరియు హాలోజన్ (VIIA) లతో పోలి ఉంటుంది.
- దీనికి కారణము అది క్షారలోహాల వలె ఎలక్ట్రానును కోల్పోగలదు, అలాగే హాలోజన్ వలె ఒక ఎలక్ట్రానును పొందగలదు.
- కానీ హైడ్రోజన్ ఎలక్ట్రాన్ విన్యాసం ప్రకారం దీనిని IA గ్రూపులో ఉంచడం జరిగినది.
![]()
ప్రశ్న 21.
మూలకాల పరమాణువుల యొక్క ఎలక్ట్రాన్ విన్యాసాలు తెలియకుండానే మెండలీవ్, నవీన ఆవర్తన పట్టికలో మూలకాల – అమరికను పోలిన అమరికతో మూలకాలను తన ఆవర్తన పట్టికలో అమర్చగలిగాడు. దీనినెలా వివరిస్తారు?
(లేదా)
మెండలీవ్, నవీన ఆవర్తన పట్టికల మధ్య గల పోలికలను వివరించుము. (AS1)
జవాబు:
- మెండలీవ్ అప్పటివరకు తెలిసిన మూలకాలను వాటి పరమాణు ద్రవ్యరాశుల ఆరోహణ క్రమములో ఒక క్రమపద్ధతిలో అమర్చి ఒక చార్టు రూపంలో తయారుచేశాడు.
- ఈ చార్టును 8 నిలువు వరుసలుగా విభజించాడు. ఆ నిలువు వరుసలు మరలా A, B అను ఉపభాగాలుగా విభజించబడి, రసాయన ధర్మాలలో సారూప్యత ఉన్న మూలకాలను కలిగి ఉన్నాయి.
- ఈ విధమైన నిలువు వరుసలకు గ్రూపులని పేరు పెట్టాడు.
- మొదటి గ్రూపులో గల మొదటి వరుస మూలకాలు ఒక సాధారణ ఫార్ములా కలిగిన సమ్మేళనాలను ఏర్పరుస్తాయని చెప్పాడు. ఆ ఫార్ములా R2O.
- మొదటి గ్రూపులో గల రెండవ వరుస మూలకాలకు ఒక సాధారణ ఫార్ములా (RO) ను ఏర్పరచాడు.
- ఆవర్తన పట్టికలో మూలకాల అమరిక ఆధారంగా మెండలీవ్ కొన్ని మూలకాలు లభ్యం కాలేదని గుర్తించి, వాటికోసం పట్టికలో నిర్దిష్ట స్థానాలలో ఖాళీగడులను విడిచిపెట్టాడు.
- మెండలీవ్ తాను ఊహించిన కొత్త మూలకాలు భవిష్యత్ లో తప్పనిసరిగా కనుగొనబడతాయని నమ్మాడు. అతని పట్టిక ఆధారంగానే కొత్త మూలకాల ధర్మాలను ముందే ఊహించాడు.
- అతడు ఊహించిన ధర్మాలు ఆ తరువాత కాలంలో కొత్తగా కనుగొనబడిన మూలకాల ధర్మాలు ఒకేలా ఉన్నాయి.
- ఎలక్ట్రాన్ విన్యాసం తెలియకుండానే మూలకాలను నవీన ఆవర్తన పట్టికకు ధగ్గరగా అప్పటి వరకు తెలిసిన మూలకాలను మెండలీవ్ అమర్చగలిగాడు.
ప్రశ్న 22.
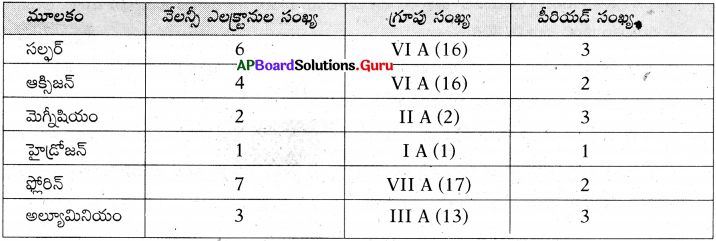
a) కింది పట్టికలో వివిధ మూలకాల వేలన్సీ ఎలక్ట్రాన్ల సంఖ్య, గ్రూపు సంఖ్య, పీరియడ్ సంఖ్యలను వ్రాయండి. (AS1)
జవాబు:
b) కింద ఇచ్చిన మూలకాల సమూహం ఏదైనా గ్రూపు మూలకాలైతే ‘G’ అని, పీరియడ్ మూలకాలైన (P) అని, ఏదీకాకపోతే (N) అని గుర్తించండి. (AS1)
జవాబు:
| మూలకాలు | G/P/N |
| Li,C,O | P |
| Mg, Ca, Ba | G |
| Br, Cl, F | G |
| C, S, Br | N |
| AI, Si, Cl | P |
| Li, Na, K | G |
| C,N,O | P |
| K, Ca, Br | P |
ప్రశ్న 23.
ప్రకృతిలో వాని విస్తృత అందుబాటు ఆధారంగా s, p – బ్లాక్ మూలకాలను (18వ గ్రూపు తప్ప) కొన్నిసార్లు ప్రాతినిధ్య మూలకాలుగా పిలుస్తారు. ఇది సరైనదేనా? ఎందుకు? (AS1)
జవాబు:
- s మరియు p బ్లాకు మూలకాలు యొక్క పరమాణువులలో చిట్టచివరి ఆర్బిటాళ్లు అసంపూర్ణంగా ఉంటాయి.
- ఈ అమరిక వలన అవి అధిక చర్యాశీలతను కలిగి, జడవాయు ఎలక్ట్రాన్ విన్యాసం కొరకు చర్యలలో అధికంగా పాల్గొంటాయి.
- కావున ఇవి అధికంగా సమ్మేళన రూపంలో లభిస్తాయి.
- అందుకనే ప్రకృతిలో ఇవి విస్తృత అందుబాటులో ఉండుట వలన వీటిని ప్రాతినిధ్య మూలకాలుగా పిలుస్తారు.
ప్రశ్న 24.
కింది జతలలో ఏ మూలకం యొక్క అయనీకరణ శక్తి తక్కువగా ఉంటుందో గుర్తించండి. (AS1)
(i) Mg లేదా Na i i) Li లేదా 0 (iii) Br లేదా F (iv) K లేదా Br
జవాబు:
ధర్మము : పీరియడ్ లో ఎడమ నుండి కుడికి పోయేకొలదీ అయనీకరణ శక్తి పెరుగును.
గ్రూపులలో పై నుండి క్రిందకు పోయేకొలదీ అయనీకరణ శక్తి తగ్గును.
(i) Mg లేదా Na :
Mg, Na లు ఒకే పీరియడ్ కు చెందినవి, Na కు అయనీకరణ శక్తి తక్కువ.
(ii) Li లేదా O :
Li, O లు ఒకే పీరియడ్ కు చెందినవి, Li కు తక్కువ అయనీకరణ శక్తి కలదు.
(iii) Br లేదా F :
Br, F లు ఒకే గ్రూపుకు చెందినవి. Br కు తక్కువ అయనీకరణ శక్తి ఉండును.
(iv) K లేదా Br :
K మరియు Br లు ఒకే పీరియడ్ కు చెందును. K యొక్క అయనీకరణ శక్తి తక్కువ.
![]()
ప్రశ్న 25.
ఆవర్తన పట్టికలో రెండవ పీరియడ్ లో ఉన్న ‘X’ అనే మూలకం ‘Y’ అనే మూలకానికి కుడివైపున ఉన్నది. అయితే వీనిలో ఏ మూలకం క్రింది ధర్మాన్ని కలిగి ఉంటుంది? (AS1)
a) అల్ప కేంద్రక ఆవేశం
b) తక్కువ పరమాణు పరిమాణం
c) అధిక అయనీకరణ శక్తి
d) అధిక ఋణవిద్యుదాత్మకత
e) అధిక లోహ స్వభావం
జవాబు:
a) Y కు X కంటే ఎక్కువ కేంద్రక ఆవేశం ఉండును.
b) Y కన్నా Xకు తక్కువ పరమాణు పరిమాణం ఉండును.
c) X కు Y కన్నా అధిక అయనీకరణ శక్తి ఉండును.
d) X కు Y కన్నా అధిక ఋణవిద్యుదాత్మకత ఉండును.
e) Y కు X కన్నా అధిక లోహ స్వభావం ఉండును.
ప్రశ్న 26.
9, 34, 46, 64 పరమాణు సంఖ్య గల మూలకాలు ఏ బ్లాకుకు చెందుతాయో ఊహించండి. (AS2)
(లేదా)
క్రింద ఇవ్వబడిన పరమాణు సంఖ్య గల మూలకాలు ఏ బ్లాకుకు సంబంధించినవో ఉదహరించుము. 9, 34, 46, 64
జవాబు:
- పరమాణు సంఖ్య ‘9’గా గల మూలకము ఎలక్ట్రాన్ విన్యాసము 1s² 2s² 2p6 ఇది p – బ్లాకుకు చెందును. (VIIA) గ్రూపులో ఉండును.
- పరమాణు సంఖ్య ’34’గా గల మూలకపు ఎలక్ట్రాన్ విన్యాసము 1s² 2s² 2p6 3s² 3p64s² 3d10 3p4 ఇది p – బ్లాకుకు చెందును. VIA గ్రూపుకు చెందును.
- పరమాణు సంఖ్య (46’గా గల మూలకపు ఎలక్ట్రాన్ విన్యాసము 1s² 2s² 2p6 3s² 3p6 4s² 3d10 4p6 5s² 4d8 ఇది d – బ్లాకుకు చెందును. VIIB కు చెందును.
- పరమాణు సంఖ్య ’64’గా గల మూలకపు ఎలక్ట్రాన్ విన్యాసము 1s² 2s² 2p6 3s² 3p6 4s² 3d10 3p6 5s² 4d10 5p6 6s² 4f8 ఇది f – బ్లాకుకు చెందును. ఇది లాంథనైడులలో ఉండును.
ప్రశ్న 27.
అల్యూమినియం, నీటితో గది ఉష్ణోగ్రత వద్ద చర్య జరపదు. కానీ సజల HCl, NaOH లతో చర్య జరుపుతుంది. వీటిని ప్రయోగం చేసి సరిచూడండి. మీ పరిశీలనలకు రసాయన సమీకరణాలు వ్రాయండి. ఈ పరిశీలనల ఆధారంగా Al ఒక అర్ధలోహం అని చెప్పగలరు? (AS3)
(లేదా)
అల్యూమినియం ఒక అర్ధలోహమని ఏ విధముగా వివరించెదవు?
జవాబు:
- అల్యూమినియం ఒక తెల్లని మెరిసే లోహము. అల్యూమినియం పైపొరను దీని ఆక్సైడ్ తో పూతవేస్తారు. ఎందుకనగా గాలి నుండి రక్షణ పొందుటకు. ఈ పొర పాడయిన, గాలి, నీరు కూడా Al ను పాడుచేస్తాయి.
- అల్యూమినియం సజల HCl తో చర్య జరిపి H2 వాయువును విడుదల చేయును.
2Al + 6HCl → 2AlCl3 + 3H2↑ - Al, NaOH తో చర్య జరిపిన H2 వాయువు విడుదలగును.
Al + H2O + 2NaOH → 2Na[Al(OH)4] + 3H2↑ - ఈ చర్యలననుసరించి Al ఆమ్లము, క్షారము రెండింటితో చర్య జరుపును.
- ఇది ఒక సున్నిత లోహము కానీ అర్ధలోహము కాదు.
ప్రశ్న 28.
VIIIA గ్రూపు మూలకాల (జడవాయువులు) చర్యాశీలతకు సంబంధించిన సమాచారాన్ని మీ పాఠశాల గ్రంథాలయం లేదా ఇంటర్నెట్ నుండి సేకరించండి. ఈ మూలకాలకు గల ప్రత్యేకతను ఆవర్తన పట్టికలో ఉన్న మిగిలిన మూలకాలతో పోల్చి ఒక నివేదికను తయారు చేయండి. (AS4)
జవాబు:
- VIIIA గ్రూపు మూలకాలకు రసాయనికముగా చర్యాశీలత తక్కువ, ఎందుకనగా ఇవన్నీ స్థిర అష్టక విన్యాసమును కలిగి ఉన్నాయి (He తప్ప).
- He కు బాహ్యకక్ష్యలలో రెండు ఎలక్ట్రానులు మాత్రమే ఉన్నా, కక్ష్య పూర్తిగా నిండి ఉన్నది. కనుక దీనికి చర్యాశీలత ఉండదు.
- జడ వాయువులకు అధిక అయొనైజేషన్ విలువ, శూన్య ఎలక్ట్రాన్ ఎఫినిటీ విలువలుండుట వలన ఇవి ఎలక్ట్రాను కోల్పోవుట (లేక) గ్రహించుట జరుగదు.
- Ar, BF, తో కలిసి సమ్మేళనాలను ఏర్పరచును.
- జడవాయువుల మొదటి సమ్మేళనము జినాన్ ఫ్లోరో ప్లాటినేట్.
- జినాన్ ఒక ఎలక్ట్రాన ను పోగొట్టుకుని ధన ఆక్సీకరణ స్థాయిలో ఉంటుంది. కనుక జినాన్ అధిక ఋణ విద్యుదాత్మకత మూలకాలైన F2 మరియు O2లతో చర్య పొంది సమ్మేళనాలను ఏర్పరచును.
ప్రశ్న 29.
ఆవర్తన పట్టిక తయారీలో ఎలక్ట్రాన్ విన్యాసం పాత్రను మీరు ఎలా ప్రశంసిస్తారు? (AS6)
(లేదా)
ఎలక్ట్రాన్ విన్యాసము, ఆవర్తన పట్టిక తయారీకి ఏ విధముగా సహాయపడినదో వివరింపుము.
(లేదా)
ఆవర్తన పట్టికలో అష్టక విన్యాసం పాత్రను నీవెలా అభినందిస్తావు?
జవాబు:
- కృత్రిమ మూలకాలతో సహా ప్రస్తుతం 115కు పైగా మూలకాలను కనుగొన్నారు.
- ఈ మూలకాల సంఖ్య పెరిగే కొద్దీ మూలకాలు, వాటి సమ్మేళనాల రసాయన సమాచారాన్ని గుర్తుంచుకోవడం శాస్త్రవేత్తలకు, విద్యార్థులకు చాలా కష్టముగా మారినది.
- అందువలన శాస్త్రీయంగా మూలకాలను వర్గీకరించవలసిన అవసరం ఏర్పడింది.
- అందుకే 1913లో బ్రిటిష్ శాస్త్రవేత్త అయిన మోస్లే X-కిరణ స్వభావాన్ని విశ్లేషించి, మూలక పరమాణువులలో ఉండే ధనావేశిత కణాల సంఖ్యను లెక్కించగలిగాడు. వీటిని పరమాణు సంఖ్య (ఎలక్ట్రాన్ విన్యాసం)గా గుర్తించాడు.
- పరమాణు సంఖ్యలను తెలుసుకున్న తర్వాత ఆవర్తన పట్టికలో వీటి ఆధారంగా మూలకాలను అమర్చడం పాతపద్ధతి (పరమాణుభారాల పద్ధతి) కన్నా మేలైనదిగా గుర్తించాడు.
- ఈ పరమాణు సంఖ్యల అమరిక ద్వారా అసంగత మూలకాల సమస్యను సులువుగా అధిగమించారు.
- ఈ పరమాణు సంఖ్యల ఆధారంగా రూపొందిన ఆవర్తన నియమం ప్రకారం ప్రతిపాదించబడినది నవీన ఆవర్తన పట్టిక.
- పరమాణు సంఖ్య, ఒక మూలకం యొక్క ధనావేశిత కణాలను మాత్రమే కాక, ఆ మూలక తటస్థ పరమాణువులోని ఎలక్ట్రాన్ల సంఖ్యను కూడా తెలుపును.
- మూలకాల యొక్క భౌతిక, రసాయన ధర్మాలు ఆ మూలక పరమాణువులోని ప్రోటాన్ల సంఖ్యపై మాత్రమే కాక ఎలక్ట్రాన్ల సంఖ్య మరియు వాటి విన్యాసాలపై కూడా ఆధారపడి ఉంటాయి.
- ఈ విధముగా మానవాళికి మూలకాల గురించి క్లుప్తంగా, తేలికగా గుర్తుంచుకునేందుకు ఉపయోగపడుతున్న నవీన ఆవర్తన పట్టిక తయారీకి ఆధారమైన ఎలక్ట్రాన్ విన్యాసం అభినందనీయమైనది.
![]()
ప్రశ్న 30.
నూతన ఆవర్తన పట్టికలో మూలకాల స్థానాలు వాటి రసాయన ధర్మాలను గుర్తించడంలో ఎలా ఉపయోగించుకుంటారు? (AS7)
జవాబు:
- మూలక పరమాణువుల ఎలక్ట్రాను విన్యాసం ఆధారంగా పరమాణువుల భౌతిక మరియు రసాయన ధర్మాలు ఆధారపడి ఉంటాయి.
- ఆవర్తన పట్టికలో మూలకాలను ఎలక్ట్రాను విన్యాసం పెరిగే క్రమంలో అమర్చారు.
- ఆవర్తన పట్టికలో మూలకాల యొక్క స్థానం ఆధారముగా వాటి రసాయన ధర్మాలను అంచనా వేయవచ్చును.
- ఆవర్తన పట్టికలో వదిలి వేయబడిన మూలకాలు మరియు లోహాలకు చర్యాశీలత ఎక్కువ.
- కుడివైపున ఉన్న పట్టికలో కల మూలకాలు అలోహాలు మరియు వాయువులు.
- 18వ గ్రూపులో ఉన్న మూలకాలను జడవాయువులని, అవి చర్యాశీలత కలిగి ఉండవు, కావున రసాయన చర్యలలో పాల్గొనవు.
- ఆవర్తన పట్టికలో ఎడమవైపు ఉన్నవి లోహాలు మరియు కుడివైపున ఉన్నవి అలోహాలు.
- లోహస్వభావం ఎడమ నుండి కుడివైపుకు తగ్గును. ఈ విధముగా రసాయన ధర్మాలను గుర్తించుటకు మూలకాల స్థానాలు ఉపయోగపడతాయి.
ఖాళీలను పూరించండి
1. లిథియం, ……………. మా యు పొటాషియంలు డాబరీనర్ త్రికములు. (సోడియం)
2. డాబరీనర్, న్యూలాండ్స్, మెండలీవ్ లు ………. ఆధారంగా మూలకాల వర్గీకరణ చేసినారు. (పరమాణుభారము)
3. ఆవర్తన పట్టికలోని అసంపూర్తి పీరియడ్ ………. (‘0’ గ్రూపు)
4. జడవాయువులు ఆవర్తన పట్టికలో ………… గ్రూపునకు చెందుతాయి. (7వ పీరియడ్)
5. ఒక గ్రూపునందు పై నుండే మూలకాల కంటే కింది వైపు ఉండే మూలకాలు …….. లోహ ధర్మాలను కలిగి ఉంటాయి. (అధికము)
సరైన సమాధానాన్ని ఎన్నుకోండి
1. నూతన ఆవర్తన పట్టిక 2వ పీరియడ్ లో ఉన్న మూలకాల సంఖ్య ………
A) 2
B) 8
C) 18
D) 32
జవాబు:
B) 8
2. VA కు చెందిన నైట్రోజన్ (N = 7) తరువాత ఆ గ్రూపులో ,వచ్చే మూలక పరమాణు సంఖ్య ………
A) 7
B) 14
C) 15
D) 17
జవాబు:
C) 15
3. 2, 8, 1 ఎలక్ట్రాన్ విన్యాసం కలిగిన ఒక మూలకం రసాయనికంగా కింది ఇచ్చిన మూలకాలలో ఏ మూలకంతో పోలి ఉంటుంది?
A) నైట్రోజన్ (Z = 7)
B) ఫ్లోరిన్ (Z = 9)
C) ఫాస్ఫరస్ (Z =15)
D) ఆర్గాన్ (Z = 18)
జవాబు:
B) ఫ్లోరిన్ (Z = 9)
4. ఈ కింది వానిలో అత్యధిక చర్యాశీలత గల లోహం…
A) లిథియం
B) సోడియం
C) పొటాషియం
D) రుబీడియం
జవాబు:
D) రుబీడియం
10th Class Physical Science 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక Textbook InText Questions and Answers
10th Class Physical Science Textbook Page No. 133
ప్రశ్న 1.
డాబరీనర్ మూలకాల మధ్య ఏవిధమైన సంబంధాన్ని నెలకొల్పాలని ప్రయత్నించాడు?
జవాబు:
డాబరీనర్ మూలకాల పరమాణుభారానికి, వాటి ధర్మాలకు మధ్య సంబంధంను నెలకొల్పాలనుకొన్నాడు. ఈ ప్రయత్నమే మూలకాల వర్గీకరణకు మరియు ఆవర్తన పట్టికకు దారి తీసినది.
ప్రశ్న 2.
కాల్షియం (Ca), బేరియం (Ba)ల సాంద్రతలు వరుసగా 1.55, 3.51 గ్రా. సెం.మీ. డాబరీనర్ త్రికసిద్ధాంతంను ఆధారంగా చేసుకొని స్క్రీన్షియం (Sr) యొక్క సాంద్రతను సుమారుగా చెప్పగలరా?
జవాబు:
Ca యొక్క సాంద్రత = 1.55 గ్రా/సెం.మీ³
Ba యొక్క సాంద్రత = 3.51 గ్రా/సెం.మీ³
సగటు సాంద్రత = \(\frac{1.55 + 3.51}{2}=2.53\)
Sr యొక్క సాంద్రత = 2.64
Ca, Ba ల సగటు సాంద్రత Sr యొక్క సాంద్రతకు దాదాపు సమానము.
10th Class Physical Science Textbook Page No. 139
ప్రశ్న 3.
పట్టికలో ఉన్న Ea2O3, ESO2ల గురించి మీరేం అర్థం చేసుకున్నారు?
జవాబు:
Ea2O3 అనునది ఎకా అల్యూమినియం యొక్క ఆక్సైడ్.
EsO2 అనునది ఎకా సిలికాన్ యొక్క ఆక్సైడ్.
![]()
ప్రశ్న 4.
క్షార లోహాలన్నీ ఘనస్థితిలో ఉండగా ద్విపరమాణుక అణువు అయిన హైడ్రోజన్ మాత్రం వాయుస్థితిలో ఉంటుంది. దీనిని IA గ్రూప్ లో క్షార లోహాల వరుసలో చేర్చడాన్ని మీరు సమర్థిస్తారా?
జవాబు:
- ఆవర్తన పట్టికలో మూలకాలను ఎలక్ట్రాను విన్యాసం ఆధారంగా పొందుపరిచారు.
- హైడ్రోజన్ యొక్క ఎలక్ట్రాన్ విన్యాసం 1s¹. దీనిలో ఒక ఎలక్ట్రాను తక్కువగా జడవాయువు విన్యాసంను కలిగి ఉంది.
- నవీన ఆవర్తన నియమం ప్రకారం హైడ్రోజనను క్షార లోహాలపై ఉంచడం సరైనదే.
10th Class Physical Science Textbook Page No. 151
ప్రశ్న 5.
రెండవ పీరియడ్ మూలకమైన ‘F’ కన్నా అదే గ్రూపుకు చెందిన మూలకమైన ‘Cl’కు ఎలక్ట్రాన్ ఎఫినిటీ విలువ ఎక్కువ. ఎందుకు?
జవాబు:
F అనునది Cl కంటే ఎక్కువ ఋణ విద్యుదాత్మకత కలిగిన మూలకం. కావున F మూలకం Cl మూలకం కంటే తక్కువ శక్తిని .విడుదల చేయును. కనుక ఎలక్ట్రాన్ ఎఫినిటీ విలువ F కన్నా CI కు ఎక్కువ.
10th Class Physical Science Textbook Page No. 134
ప్రశ్న 6.
న్యూలాండ్స్ అష్టక నియమాన్ని ఎందుకు ప్రతిపాదించాడో మీకు తెలుసా? ఆధునిక పరమాణు నిర్మాణం పరంగా మీ జవాబును వివరించండి.
జవాబు:
1) న్యూలాండ్స్ మూలకాలను పరమాణు ద్రవ్యరాశుల ఆరోహణ క్రమంలో అమర్చగా, మొదటి మరియు ఎనిమిదవ మూలకాలకు ఒకే రకమైన ధర్మాలు కలవు.
2) ఆధునిక ఆవర్తన పట్టికలో ప్రతి పీరియడ్ క్రొత్త కక్ష్యతో ప్రారంభమై అది నిండిన తర్వాత మరలా క్రొత్త కక్ష్య ప్రారంభమగును. కక్ష్యా నియమము అష్టక విన్యాసంను పాటించును.
ప్రశ్న 7.
న్యూలాండ్స్ ప్రతిపాదించిన అష్టక నియమం సరైనదేనని భావిస్తున్నారా? ఎందుకు?
జవాబు:
న్యూలాండ్స్ అష్టక నియమంలో కొన్ని లోపాలు కలవు.
- ఒకే గడిలో రెండు మూలకాలను పొందుపరుచుట.
- పూర్తిగా భిన్నమైన ధర్మాలు గల కొన్ని మూలకాలను ఒకే గ్రూపులో అమర్చుట.
- ఈ నియమం కాల్షియం వరకే పరిమితమవుట మొదలైనవి.
10th Class Physical Science Textbook Page No. 139
ప్రశ్న 8.
మెండలీవ్ కొన్ని ఖాళీలను తన ఆవర్తన పట్టికలో ఎందుకు విడిచిపెట్టాడు? దీనికి నీవిచ్చే వివరణ ఏమిటి?
జవాబు:
- ఆవర్తన పట్టికలో మూలకాల అమరిక ఆధారంగా మెండలీవ్ కొన్ని మూలకాలు లభ్యం కావడం లేదని గుర్తించి, వాటి కోసం పట్టికలో నిర్దిష్ట స్థానాలలో ఖాళీ గడులను విడిచి పెట్టాడు.
- అతడు రూపొందించిన పట్టిక ఆధారముగా ఆ కొత్త మూలకాల ధర్మాలను ముందుగానే ఊహించాడు.
- అతడు ఊహించిన ధర్మాలు ఆ తర్వాత కాలంలో కొత్తగా కనుగొనబడిన మూలకాల ధర్మాలకు ఒకేలా ఉన్నాయి.
10th Class Physical Science Textbook Page No. 145
ప్రశ్న 9.
లాంథనై లు, ఆక్టిడ్ లను ప్రత్యేకంగా ఆవర్తనపట్టిక అడుగు భాగాన ఉంచడం ఎందుకు జరిగింది?
జవాబు:
లాంథనైలు, ఆక్టిన్ లను ఆవర్తన పట్టికలో పొందుపరచిన ఆవర్తన పట్టిక పరిమాణం మరింతగా పెరుగుతుంది. గ్రూపుల సంఖ్య మరొక 14 పెరుగుతుంది. అందుకే వీటిని ఆవర్తన పట్టిక అడుగున ఉంచడమైనది.
10th Class Physical Science Textbook Page No. 149
ప్రశ్న 10.
మొదటి అయనీకరణ శక్తి కన్నా రెండవ అయనీకరణ శక్తి ఎక్కువ ఉంటుంది. ఎందుకు?
జవాబు:
- వేలన్సీ ఆర్బిటాల్ లోని ఎలక్ట్రాన్ మీద కేంద్రక ఆకర్షణ, తటస్థ పరమాణువులో కంటే ధన అయాన్లో ఎక్కువ ఉంటుంది.
- అందువలన రెండవ ఎలక్ట్రాన్ తొలగించుటకు ఎక్కువ శక్తి అవసరము. కనుక రెండవ అయనీకరణ శక్తి, మొదటి అయనీకరణ శక్తి కంటే ఎక్కువ.
10th Class Physical Science Textbook Page No. 151
ప్రశ్న 11.
క్షారమృత్తిక లోహాలు, జడవాయువుల ఎలక్ట్రాన్ ఎఫినిటీ విలువలు ధనాత్మకంగా ఉంటాయి. ఎందుకు?
జవాబు:
- క్షార మృత్తిక లోహాల ఎలక్ట్రాన్ విన్యాసం (ns²) పరముగా అవి స్థిరంగా ఉంటాయి.
- ఈ లోహాల బాహ్య కక్ష్యలోకి ఎలక్ట్రానులను చేర్చడం కష్టము. కావున వీటి యొక్క ఎలక్ట్రాన్ ఎఫినిటీ విలువ ధనాత్మకము.
- అదే విధముగా జడ వాయువుల ఎలక్ట్రాన్ విన్యాసము స్థిర అష్టకమును కలిగి ఉంటాయి. కనుక వీటికి ఎలక్ట్రాను చేర్చుటకు అధిక శక్తి అవసరము. కావున వీటి ఎలక్ట్రాన్ ఎఫినిటీ విలువ ధనాత్మకము.
10th Class Physical Science Textbook Page No. 139
ప్రశ్న 12.
పరమాణు సంఖ్య అంటే ఏమిటి?
జవాబు:
ఒక మూలక పరమాణువులో ఉన్న ధనావేశిత కణాల సంఖ్యను ఆ మూలకం యొక్క పరమాణు సంఖ్య అంటారు.
![]()
10th Class Physical Science Textbook Page No. 148
ప్రశ్న 13.
కింది జతలలో దేని పరిమాణం లేదా వ్యాసార్ధం ఎక్కువ? కారణాలు రాయండి.
a)Na, Al b) Na, Mg+2 c) S2-, Cl– d) Fe2+, Fe3+ e) C4-, –.
జవాబు:
a) Na కు పరిమాణం ఎక్కువ. కారణం : Na లో కంటే AI లో కేంద్రక ఆవేశం ఎక్కువ.
b) Na కు పరిమాణం ఎక్కువ. కారణం : Na లో 3 కక్ష్యలు ఉంటాయి. Mg+2 లో 2 కక్ష్యలే ఉంటాయి.
c) S2-కు పరిమాణం ఎక్కువ. కారణం : S-2 లో కంటే Cl– లో కేంద్రక ఆవేశం ఎక్కువ.
d) Fe2+ కు పరిమాణం ఎక్కువ. కారణం : Fe+2, Fe+3 ల కేంద్రక ఆవేశం సమానమైననూ Fe+3 లో ఎలక్ట్రాన్ల
సంఖ్య తక్కువ కావున Fe+3 పరిమాణం తక్కువ
e) C4- కు పరిమాణం ఎక్కువ. కారణం : C4- లో కంటే F– లో కేంద్రక ఆవేశం ఎక్కువ.
10th Class Physical Science Textbook Page No. 148
ప్రశ్న 13.
Na, Na+ లలో దేనికి ఎక్కువ వ్యాసార్ధం లేదా పరిమాణం ఉంటుంది. ఎందుకు?
జవాబు:
- సోడియం పరమాణువు ఒక ఎలక్ట్రాన్ ను కోల్పోయి సోడియం కాటయాన్ (Na+) ను ఏర్పరచును.
- సోడియం పరమాణు సంఖ్య 11. దీనిలో 11 ప్రోటాన్లు, 11 ఎలక్ట్రానులు ఉంటాయి. దీని బాహ్య విన్యాసం 3s¹.
- సోడియం కాటయాన్ (Na+) లో 11 ప్రోటాన్లు, 10 ఎలక్ట్రానులుంటాయి. దీని 3s ఉపకక్ష్యలో ఎలక్ట్రానులు ఉండవు. కావున దీని బాహ్య ఎలక్ట్రాన్ విన్యాసం 2s² 2p6 అగును.
- దీనినిబట్టి Na పరమాణు వ్యాసార్ధం కన్నా Na+ అయాన్ వ్యాసార్ధం తక్కువగా ఉంటుంది.
పరికరాల జాబితా
ఆవర్తన పట్టికకు సంబంధించిన చార్టు, ఫ్లాష్ కార్డులు
10th Class Physical Science 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక Textbook Activities
కృత్యములు
కృత్యం – 1
ప్రశ్న 1.
కింది పట్టికను పరిశీలించండి. ప్రతి అడ్డు వరుస ఒక త్రికాన్ని సూచిస్తుంది.
పట్టిక
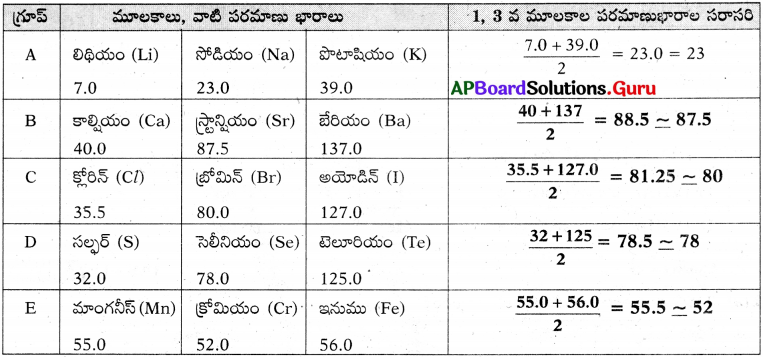
జవాబు:
పై పట్టిక నుండి
- మిగిలిన అడ్డు వరుసల్లోని మూలకాల సమూహాల మధ్య కచ్చిత విలువ గల సంబంధంను చూపలేము.
- మొదటి, చివరి మూలకాల పరమాణుభారాల సగటు, మధ్య మూలకమునకు దాదాపుగా సమానము.
- మూలకాల ధర్మాలకు వాటి పరమాణు ద్రవ్యరాశులకు సహసంబంధము కలదని గమనించవచ్చును.
కృత్యం – 2
ప్రశ్న 2.
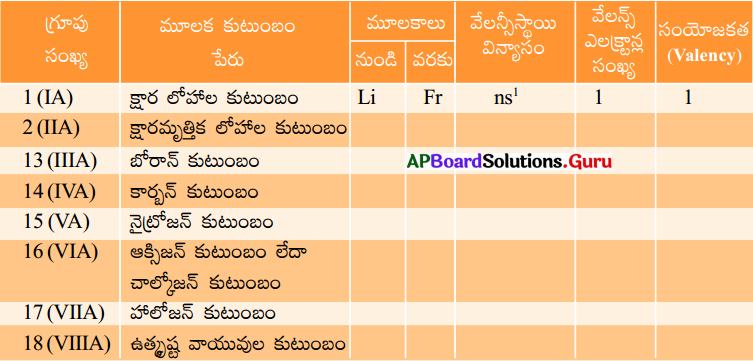
జవాబు:
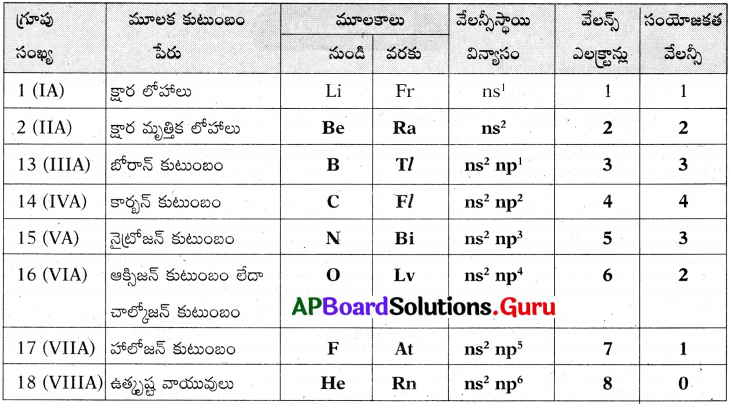
కృత్యం -3
ప్రశ్న 3.
(a) మొదటి 20 మూలకాల సంయోజకతలను లెక్కించండి.
జవాబు:
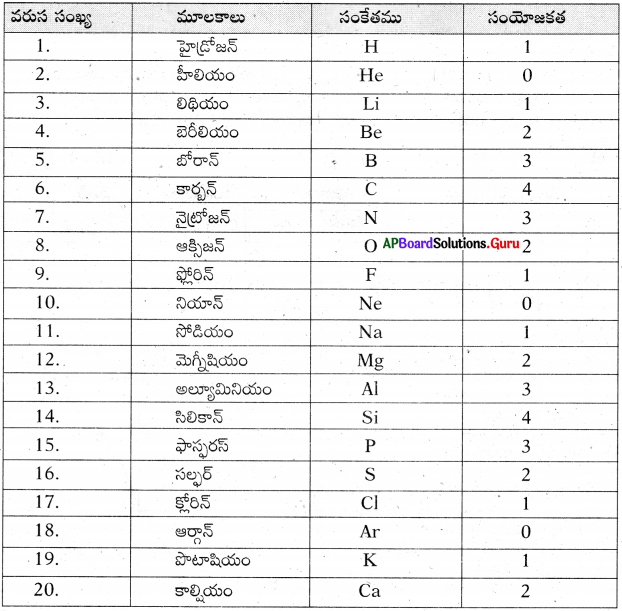
b) పీరియలో ఎడమ నుండి కుడికి పోయే కొద్దీ సంయోజకత ఏ విధంగా మార్పు చెందుతుంది?
జవాబు:
పీరియడ్ లో ఎడమ నుండి కుడికి పోయే కొలదీ మూలకాల వేలన్సీ 1 నుండి 4 దాకా పెరిగి, ఆ తర్వాత క్రమేపీ తగ్గి ‘0’కు వచ్చి మరలా క్రమేపీ పెరుగుతుంది.
![]()
c) గ్రూపులో పై నుండి కిందికి పోయే కొద్దీ సంయోజకతలో ఎటువంటి మార్పు వస్తుంది?
జవాబు:
గ్రూపులలో పై నుండి కిందికి పోయేకొద్దీ సంయోజకతలో ఎటువంటి మార్పూ రాదు.